
Twee op de drie geneesmiddelen of bijkomende indicaties die in België geen terugbetaling krijgen, verkrijgen die wel in minstens drie van de EU6 landen
Jaarlijks wordt de toegang tot innovatieve geneesmiddelen in België vergeleken met die van andere Europese landen in het kader van de W.A.I.T.-indicator (Waiting to Access Innovative Therapies). Deze studie gaat na of geneesmiddelen die door het Europees Geneesmiddelenbureau (European Medicines Agency – EMA) vergund worden, in de verschillende Europese landen terugbetaald worden.

Begin januari 2025 werd slechts 51 % van de 173 geneesmiddelen, goedgekeurd tussen 2020 en 2023, in België terugbetaald.
België scoort matig in vergelijking met de ons omringende landen en de EU6, een groep van zes landen die door onze overheid als "referentielanden" beschouwd worden: Duitsland (90 %), Oostenrijk (82 %), Frankrijk (60 %), Nederland (58 %), Finland (50 %) en Ierland (31 %).
Jaarlijkse voert pharma.be een analyse uit over de uitkomst van de terugbetalingsaanvragen van haar leden in het voorafgaande jaar. Uit deze analyse blijkt dat in 2024 slechts 68 % van de innovatieve geneesmiddelen of nieuwe indicaties, waarvoor in België een terugbetalingsaanvraag werd ingediend, definitief of tijdelijk terugbetaald raakten. Dus meer dan 30 % van de geneesmiddelen of nieuwe indicaties werd niet aanvaard voor terugbetaling in België.
pharma.be bevraagt ook jaarlijks haar leden die een innovatief geneesmiddel/nieuwe indicatie met negatieve terugbetalingsuitkomst hadden in België in het voorgaande jaar om na te gaan hoe de waardebeoordeling voor deze geneesmiddelen is door andere erkende Health Technology Assessment (HTA) autoriteiten en wat de terugbetalingsstatus van deze geneesmiddelen/indicaties is in de EU6.

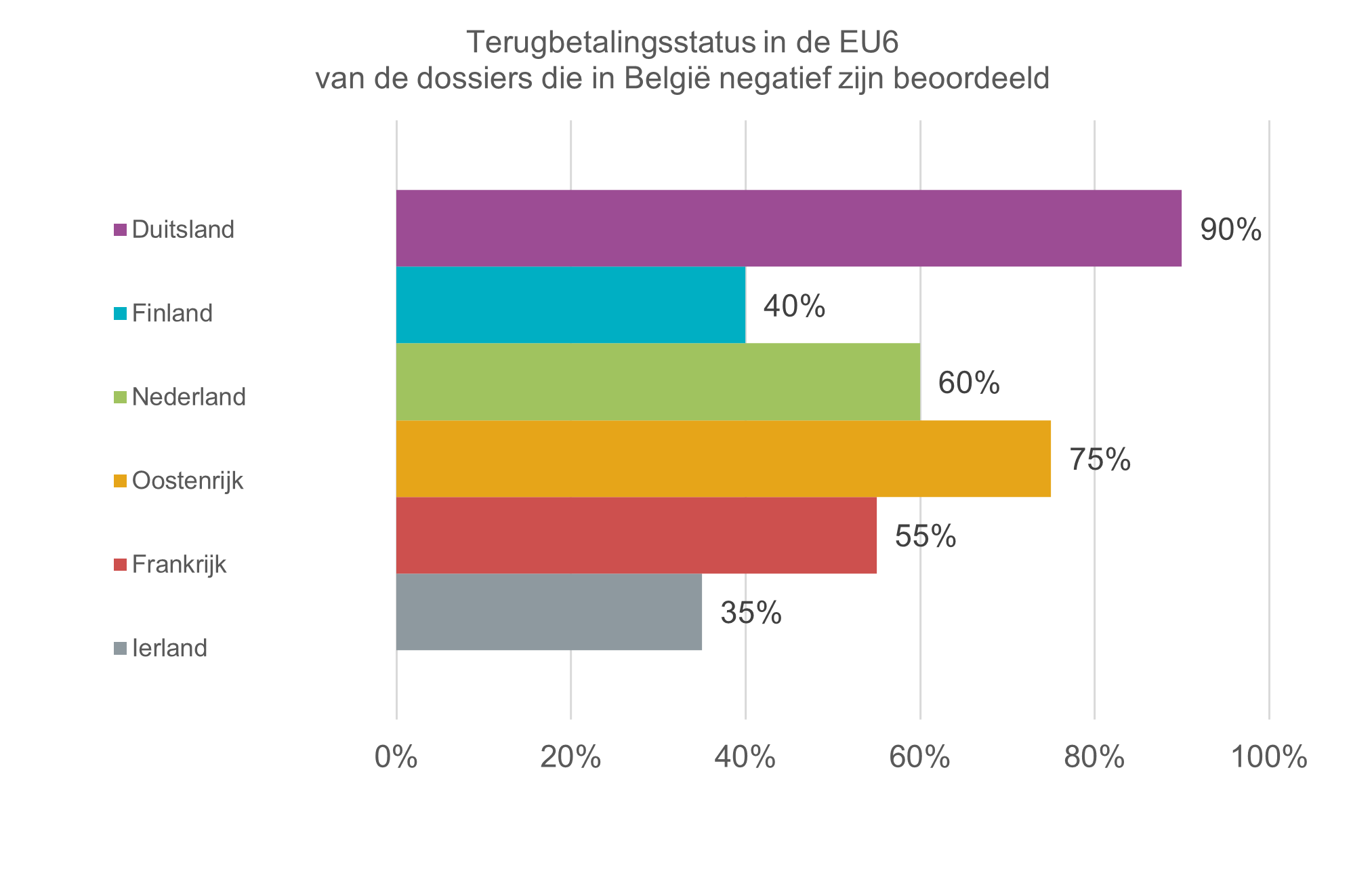
In scope van deze analyse waren 20 dossiers voor innovatieve geneesmiddelen of nieuwe indicaties die in 2024 voor het laatst besproken werden in de Commissie Tegemoetkoming Geneesmiddelen (CTG) én waarvoor in september 2025 nog steeds geen terugbetaling bekomen was in België. Ongeveer twee derde (65 %) werd in minstens de helft van de EU6 landen terugbetaald.
25 % werd terugbetaald in zowel Nederland, Oostenrijk als Ierland, een belangrijke groep van landen in het BeNeLuxA samenwerkingsverband om de terugbetaling van geneesmiddelen te bevorderen. 15 % van de geneesmiddelen/indicaties die niet terugbetaald raakten in België, werden zelfs in de gehele EU6 terugbetaald.
Onder de geneesmiddelen/indicaties met negatieve terugbetalingsuitkomst in België was er ook een erkende medische nood:
- Waaronder vier weesgeneesmiddelen, dat zijn geneesmiddelen die bij het EMA de weesstatus krijgen omdat ze bedoeld zijn voor de behandeling van een zeldzame levensbedreigende of chronische sterk invaliderende ziekte waarvoor geen doeltreffende behandeling is goedgekeurd of ten opzichte waarvan het geneesmiddel een significant voordeel heeft.
- Voor drie van de tien “klasse 1” dossiers (dossiers waarvoor door het bedrijf een meerwaarde wordt geclaimd vs. de bestaande alternatieven) – werd de meerwaarde bevestigd door de CTG.
- Voor drie van de twintig geneesmiddelen/indicaties werd door de Belgische overheid een “compassionate use” of “medisch nood” programma goedgekeurd, wat enkel mogelijk is wanneer er een onvervulde medische nood is.
- Twee van de twintig geneesmiddelen/indicaties behaalden in Frankrijk een ASMR [1] score van III. Deze ASMR-score wordt door de overheid bepaald en weerspiegelt de therapeutische (meer)waarde van het geneesmiddel/de indicatie. Een ASMR score III is een uitzonderlijke score.
Gezien de klinische evaluatie, waardebeoordeling en prijstoekenning op nationaal niveau plaatsvinden, is het niet onwaarschijnlijk dat er verschillen tussen de Europese landen bestaan. Het is zorgwekkend dat geneesmiddelen waarvoor onze eigen overheid erkent dat er een onvervulde medische nood bestaat en waarvoor andere landen een meerwaarde erkennen op basis van dezelfde klinische gegevens (en tevens vergoed worden), niet terugbetaald raken in België.
Daarbij maken we ook de kanttekening dat België geografisch gezien een klein Europees land is, maar wel één met een grote impact op de internationale referentieprijzen, doordat de prijs in België direct of indirect impact heeft op de prijzen in tientallen andere landen. Dit zorgt in globale context voor extra druk door de omvang van de recente nooit eerder geziene prijsdrukkingsmaatregel Most Favoured Nation voor geneesmiddelenprijzen in de VS. Deze maatregel is bedoeld om de kosten van geneesmiddelen in de VS te verlagen door de prijzen af te stemmen op de laagste prijs in een groep vergelijkbare landen (vaak ontwikkelde landen). Concreet legt de Amerikaanse overheid een plafond vast op basis van deze minimumprijs in het buitenland, om te voorkomen dat Amerikanen aanzienlijk meer betalen dan elders.
We hopen ten stelligste dat de geplande hervorming van de Belgische terugbetalingsprocedures en Europese initiatieven ertoe zal leiden dat meer patiënten sneller toegang krijgen tot innovatieve geneesmiddelen die hun medische nood vervult. Zo beoogt de Early and Fast Access procedure van het RIZIV die op 1 januari 2026 in voege treedt, een vroegtijdige tijdelijke terugbetaling te bekomen voor beloftevolle geneesmiddelen die de hoogste medische noden beantwoorden. Daarnaast zal de Europese Joint Clinical Assessment (JCA [2]) er hopelijk voor zorgen dat de klinische waarde in een meer uniforme manier erkend wordt in de EU. Wij rekenen erop dat België als coördinator van het HTA consortium hierbij werkt aan een kwaliteitsvolle beoordelingsprocedure en een voorbeeld zal worden in de top-5 Europese landen voor de beschikbaarheid van innovatieve geneesmiddelen.
We mogen best trots zijn dat België een pharma valley is en we willen dat dat zo blijft. We moeten er dan ook alles aan doen om de toegang tot innovatieve geneesmiddelen voor de patiënten te vrijwaren en zelfs te verbeteren.

[1] Amélioration du service médical rendu (verbetering van de medische dienstverlening)
[2] Joint Clinical Assessment: bepaald bij de EU HTA regeling (2021/2282) = verplichte EU-level wetenschappelijke evaluatie van relatieve klinische werkzaamheid en veiligheid van nieuwe geneesmiddelen. Gestart op 12/01/2025 voor eerste type geneesmiddelen (oncologie, ATMP).

Schrijf je in op onze nieuwsbrief
Wil je op de hoogte blijven van het reilen en zeilen binnen de farma-industrie, schrijf je dan in op onze nieuwsbrief!


