
Deux médicaments ou indications supplémentaires sur trois qui ne sont pas remboursés en Belgique le sont dans au moins trois des pays de l'UE6
Chaque année, l'accès aux médicaments innovants en Belgique est comparé à celui des autres pays européens dans le cadre de l’indicateur W.A.I.T. (Waiting to Access Innovative Therapies). Cette étude examine si les médicaments autorisés par l'Agence européenne des médicaments (European Medicines Agency – EMA) sont remboursés dans les différents pays européens.

Les derniers résultats début janvier 2025 montraient que seuls 51% des 173 médicaments approuvés entre 2020 et 2023 étaient remboursés en Belgique.
La Belgique obtient un score modéré par rapport à nos pays voisins et à l'UE6, un groupe de six pays considérés comme des « pays de référence » par notre gouvernement : Allemagne (90 %), Autriche (82 %), France (60 %), Pays-Bas (58 %), Finlande (50 %) et Irlande (31 %).
Chaque année, pharma.be réalise une analyse des résultats des demandes de remboursement introduites par ses membres au cours de l’année précédente. Cette analyse révèle qu’en 2024, seuls 68 % des médicaments innovants ou des nouvelles indications ayant fait l’objet d’une demande de remboursement en Belgique ont été remboursés, de manière définitive ou temporaire. Autrement dit, plus de 30 % de ces médicaments ou indications n’ont pas obtenu de remboursement en Belgique.
Par ailleurs, nous interrogeons également chaque année nos membres dont un médicament innovant ou une nouvelle indication a reçu une décision négative en matière de remboursement en Belgique l’année précédente. L’objectif est de vérifier comment ces médicaments sont évalués par d’autres autorités des technologies de la santé (Health Technology Assessment – HTA) reconnues et de connaître leur statut de remboursement dans les pays de l’UE6.

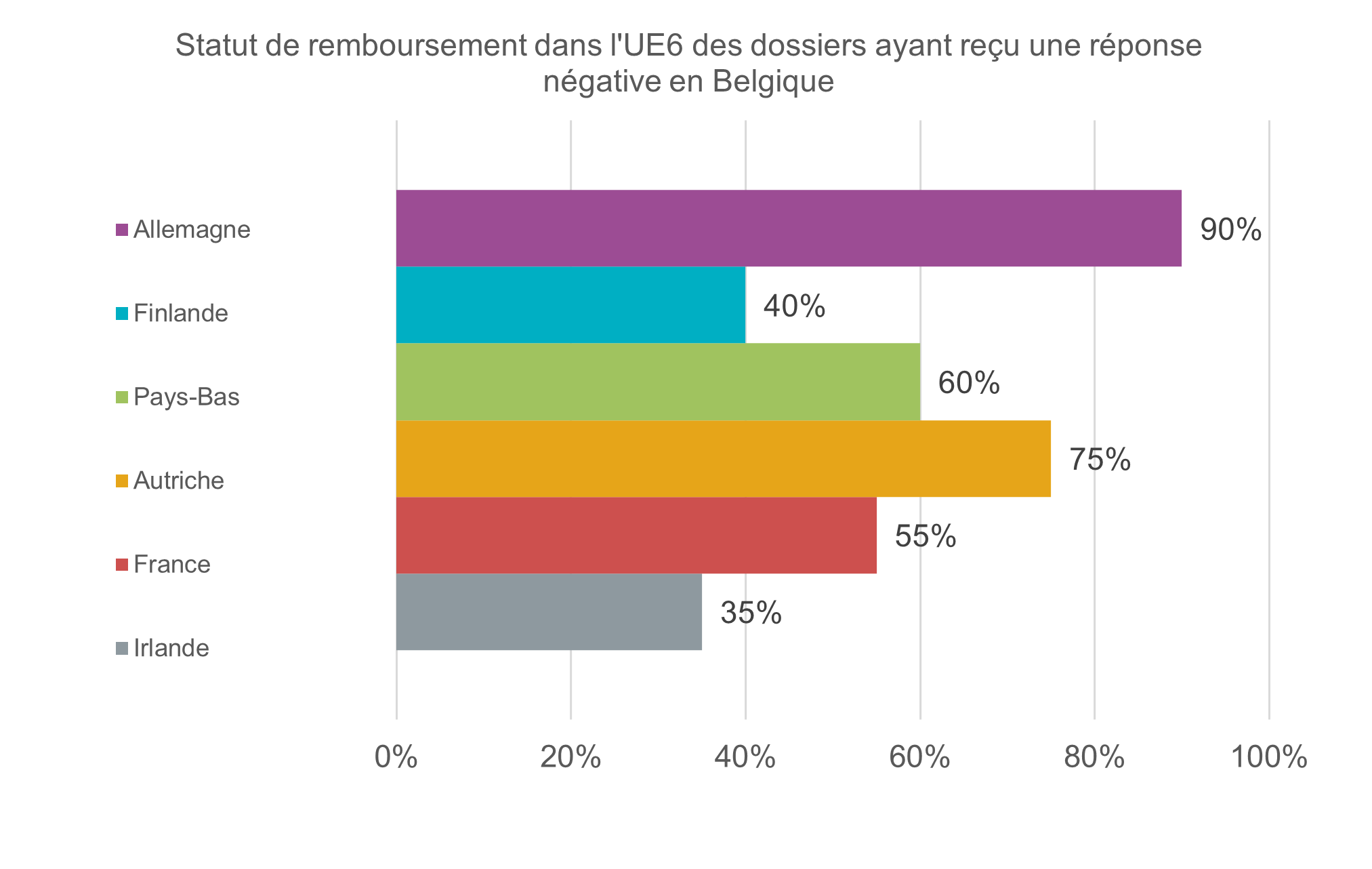
Cette analyse a porté sur 20 dossiers concernant des médicaments innovants ou de nouvelles indications, examinés pour la dernière fois par la Commission de remboursement des médicaments (CRM) en 2024 et qui, en septembre 2025, n’avaient toujours pas obtenu de remboursement en Belgique. Environ deux tiers (65 %) de ces médicaments ont été remboursés dans au moins la moitié des pays de l’UE6. 25 % ont obtenu un remboursement à la fois aux Pays-Bas, en Autriche et en Irlande, un groupe de pays clé dans le cadre du partenariat BeNeLuxA visant à promouvoir l’accès au remboursement des médicaments. 15 % des médicaments ou indications non remboursés en Belgique l’ont été dans l’ensemble des pays de l’UE6.
Parmi les médicaments ou indications non remboursés en Belgique, certains répondaient pourtant à un besoin médical reconnu :
- Quatre médicaments orphelins, c’est-à-dire des traitements ayant obtenu le statut d’orphelin par l’EMA car destinés à soigner une maladie rare mettant en jeu le pronostic vital ou une pathologie chronique gravement invalidante, sans traitement efficace approuvé ou présentant un avantage thérapeutique significatif.
- Trois dossiers de « classe 1 » (sur dix), pour lesquels l’entreprise revendiquait une valeur ajoutée par rapport aux alternatives existantes, ont vu cette valeur ajoutée confirmée par le CTG.
- Trois médicaments ou indications ont bénéficié d’un programme d’usage compassionnel ou de besoin médical approuvé par le gouvernement belge, ce qui n’est possible que lorsqu’il existe un besoin médical non satisfait.
- Deux des 20 médicaments/indications ont obtenu un score ASMR [1] de III en France. Ce score ASMR est déterminé par le gouvernement et reflète la valeur thérapeutique (ajoutée) du médicament/de l'indication. Un score ASMR III est un score exceptionnel.
Étant donné que l’évaluation clinique, l’appréciation de la valeur et la fixation des prix s’effectuent au niveau national, il n’est pas surprenant que des différences existent entre pays européens. Cependant, il est préoccupant que des médicaments reconnus par notre propre gouvernement comme répondant à un besoin médical non satisfait, et considérés comme apportant une valeur ajoutée par d’autres pays sur la base des mêmes données cliniques où ils sont même remboursés, ne le soient pas en Belgique.
Nous constatons également que, bien que la Belgique soit un petit pays sur le plan géographique, elle exerce un impact majeur sur les prix de référence internationaux. En effet, le prix fixé en Belgique influence directement ou indirectement les prix dans des dizaines d’autres pays. Cette situation crée une pression supplémentaire dans un contexte mondial marqué par la récente mesure américaine sans précédent de « Most Favored Nation ». Cette réforme américaine a pour objectif de réduire le coût des médicaments en alignant les prix sur le prix le plus bas observé dans un groupe de pays comparables, souvent des pays développés. Concrètement, le gouvernement américain fixe un plafond basé sur ce prix minimum afin d’éviter que les patients américains ne paient beaucoup plus qu’ailleurs.
Dans ce contexte, nous espérons vivement que la réforme des procédures de remboursement en Belgique et les initiatives européennes permettront à un plus grand nombre de patients d’accéder plus rapidement aux médicaments innovants répondant à leurs besoins médicaux. La procédure Early and Fast Access de l’INAMI, par exemple, qui entrera en vigueur le 1er janvier 2026, vise à garantir un remboursement temporaire précoce pour les médicaments prometteurs répondant aux besoins médicaux les plus critiques. De plus, la mise en place de l’évaluation clinique conjointe européenne (Joint Clinical Assessment – JCA [2]) devrait favoriser une reconnaissance plus homogène de la valeur clinique au sein de l’UE. Nous comptons sur la Belgique, en tant que coordinateur du consortium HTA, pour assurer une procédure d’évaluation de qualité et devenir un exemple parmi les cinq premiers pays européens en matière de disponibilité des médicaments innovants.
La Belgique peut être fière de son statut de pharma valley. Nous voulons qu’elle le reste. Pour cela, nous devons tout mettre en œuvre afin de préserver et améliorer l’accès des patients aux traitements innovants.

[1] Amélioration du service médical rendu
[2] Évaluation clinique conjointe (Joint Clinical Assessment) : définie par le règlement européen sur l’évaluation des technologies de santé (HTA) (2021/2282) = évaluation scientifique obligatoire au niveau européen de l’efficacité clinique relative et de la sécurité des nouveaux médicaments. Mise en œuvre depuis le 12/01/2025 pour une première catégorie de médicaments (oncologie, ATMP)

Intéressé(e) à recevoir les nouvelles de pharma.be
Etre au courant de ce qui vit au sein de l'industrie pharmaceutique ? Inscrivez-vous à notre lettre d'information.


