
De toegang tot innovatieve geneesmiddelen in België kan beter
EFPIA, de Europese federatie van de (bio)farmaceutische sector, publiceert jaarlijks de WAIT indicator ("Waiting to Access Innovative Therapies"), een analyse die de toegang van patiënten tot innovatieve geneesmiddelen in verschillende Europese landen vergelijkt. De laatste resultaten tonen dat slechts 46 % van de 167 geneesmiddelen goedgekeurd tussen 2019 en 2022 in België wordt terugbetaald.
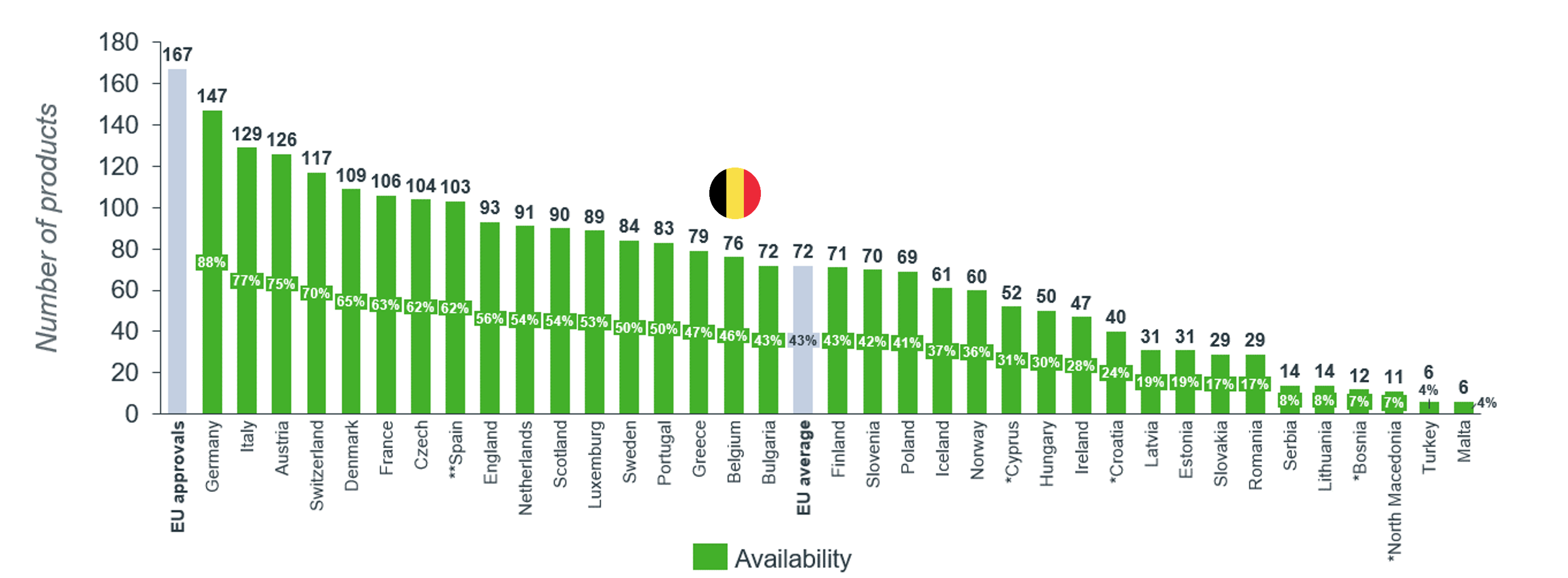
België scoort matig in vergelijking met de ons omringende landen (België heeft de laagste score) en de groep van zes landen die door onze overheid als ‘referentielanden’ beschouwd worden (Duitsland (88 %), Oostenrijk (75 %), Frankrijk (63 %), Nederland (54 %), Finland (43 %) en Ierland (28 %)).
Bovendien gaat de toegang tot innovatieve geneesmiddelen in België erop achteruit: vorig jaar waren 51 % van de recent goedgekeurde geneesmiddelen in ons land terugbetaald en het jaar ervoor was dat nog 54 %.
Patiënten moeten ook lang wachten op de terugbetaling van een geneesmiddel in België: gemiddeld duurt het 565 dagen voor een geneesmiddel terugbetaling kan genieten. Dit is langer dan vorig jaar (546 dagen) en het jaar ervoor (534 dagen). In vergelijking met andere Europese landen is België daarmee één van de traagste.
Hoewel de toegang tot geneesmiddelen in de Europese Unie globaal ook achteruit gaat, behoort België tot een groep landen waar zowel het aandeel terugbetaalde geneesmiddelen als de wachttijd tot terugbetaling erop achteruit gaan.
Hoe kunnen we deze cijfers verklaren?
- Een geneesmiddel kan in België pas terugbetaald worden als het farmaceutisch bedrijf een terugbetalingsaanvraag indient bij de Commissie Tegemoetkoming Geneesmiddelen (CTG). De WAIT indicator analyse maakt geen onderscheid tussen bij de CTG ingediende of niet ingediende geneesmiddelen. Uit verdere analyses van EFPIA en pharma.be blijkt dat minstens 70 % van de vergunde geneesmiddelen wordt ingediend in België en dit aandeel blijkt stabiel. Meer nog, dit percentage is in lijn met dat van andere West-Europese landen en behoort tot de hoogste van Europa. Bovendien wordt 5 % van de vergunde (maar niet bij de CTG ingediende) geneesmiddelen via ‘medische noodprogramma’s’ door bedrijven toegankelijk gemaakt voor Belgische patiënten [1].
- Eens ingediend worden ongeveer 7 op de 10 geneesmiddelen in België terugbetaald. Dit betekent dat er nog altijd 3 op de 10 geneesmiddelen niet aanvaard worden voor terugbetaling in ons land. Een recente analyse toonde aan dat deze geneesmiddelen vaak terugbetaald worden in de zes referentielanden en sommige aan een hoge medische nood beantwoorden (compassionate use of medisch noodprogramma goedgekeurd door het Belgisch Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten en/of matig tot majeure therapeutische waarde herkend door de Franse overheden).
Meer info in onze Nieuwsbrief van april 2023
- De gemiddelde wachttijd van 565 dagen wordt beïnvloed door de duur tussen de goedkeuring van het geneesmiddel door het Europees Geneesmiddelenagentschap (EMA) en de indiening van het terugbetalingsdossier door het farmaceutisch bedrijf en door de duur van de terugbetalingsprocedure. Bedrijven dienen gemiddeld vijf maanden na EMA-goedkeuring een terugbetalingsdossier in België in [2]. Er blijven dus gemiddeld ongeveer 400 dagen over voor de terugbetalingsprocedure. Een bedrijf kan tijdens deze evaluatie vragen om de procedure te schorsen om bijkomende informatie aan te leveren. Vaak blijkt dit noodzakelijk om de waarde van het geneesmiddel verder uit te klaren, met ondersteuning van externe klinische experten. Vaak is er ook een schorsing (maximum 120 dagen) om een managed-entry agreement te onderhandelen voor nieuwe producten met klinische of financiële onzekerheden. Als men de schorsingen tijdens de CTG-procedure niet meetelt, duurt de terugbetalingsprocedure gemiddeld 200 dagen [3].
- De belangrijkste redenen om een terugbetalingsdossier niet of uitgesteld in te dienen in België liggen vooral aan de evaluatieprocedure: de klinische data die tot de vergunning van het geneesmiddel leidden worden vaak door de CTG niet robuust genoeg geacht voor terugbetaling en de procedure kan onvoorspelbaar zijn [4].
Wat houdt de toekomst in?
De terugbetaling van een geneesmiddel is het resultaat van een procedure waarvan de duur en de uitkomst zowel door farmaceutische bedrijven als door de overheid beïnvloed kunnen worden. Beide streven naar een zo breed en snel mogelijke toegang voor alle patiënten die baat hebben bij een therapie. Er is een gezamenlijke verantwoordelijkheid om erover te waken dat de evolutie in toegang tot geneesmiddelen, die WAIT vandaag blootlegt, niet verder achteruitgaat. Vandaag worden zowel op Europees als op Belgisch niveau belangrijke hervormingen uitgewerkt om enerzijds de toegang tot geneesmiddelen te verbeteren en anderzijds onderzoek en ontwikkeling naar innovatie te stimuleren. Deze hervormingen omvatten o.a. een gecentraliseerde evaluatie van de klinische waarde van een geneesmiddel door de 27 EU-lidstaten, snellere toegang tot geneesmiddelen die een hoge medische nood invullen, gestroomlijnde CTG-procedures en het betrekken van patiëntenorganisaties in de terugbetalingsprocedure. pharma.be roept op tot de verderzetting van een constructieve dialoog met alle betrokken partijen om de toegang tot innovatieve geneesmiddelen in België te verbeteren en ervoor te zorgen dat de positie van België binnen Europa niet verder achteruitgaat.

[1] Bron: CRA Root Causes of unavailability and delay report (2024); European Access Hurdles Portal: Results from the second year of data collection CRA, EFPIA (2024); pharma.be
[2] Bron: RIZIV
[3] Bron: RIZIV
[4] Bron: CRA Root Causes of unavailability and delay report (2024); European Access Hurdles Portal: Results from the second year of data collection CRA, EFPIA (2024); pharma.be

Schrijf je in op onze nieuwsbrief
Wil je op de hoogte blijven van het reilen en zeilen binnen de farma-industrie, schrijf je dan in op onze nieuwsbrief!


