
Zeldzame ziekten en weesgeneesmiddelen
Wat is een zeldzame ziekte?
Volgens een Europese definitie wordt een ziekte als zeldzaam beschouwd wanneer ze minder dan een persoon op 2.000 treft. In België betekent dit een maximum van 5.500 patiënten per ziekte. Maar zeldzaam wil niet zeggen dat het hier om een beperkt aantal personen gaat. Volgens schattingen zouden er wereldwijd 7.000 zeldzame ziekten bestaan, die ongeveer 350 miljoen mensen treffen [1]. Er zijn geen cijfers voor België voorhanden, maar het gaat om enkele duizenden personen. De meeste zeldzame ziekten hebben een genetische oorsprong en komen in 75% van de gevallen voor bij kinderen [2]. Ze vormen bijgevolg een groot probleem voor de volksgezondheid.
Weesgeneesmiddelen, een uitdaging voor de innoverende bedrijven
Ondanks het feit dat een 500.000-tal Belgen lijden aan een zeldzame ziekte, bestaat er voor slechts 5% van de zeldzame ziekten momenteel een geregistreerde geneesmiddelenbehandeling. We stellen bovendien vast dat 35% van de medische noodprogramma's en programma's voor gebruik in schrijnende gevallen weesgeneesmiddelen betreft. Maar de uitdagingen voor onderzoek naar weesziekten zijn talrijk en complex...
Al deze elementen vragen om een specifiek regelgevend kader voor weesgeneesmiddelen.
Een doeltreffend Europees regelgevend kader specifiek voor weesgeneesmiddelen
Europa heeft in 2000 een aantal maatregelen goedgekeurd om het onderzoek, de ontwikkeling en het in de handel brengen van weesgeneesmiddelen te stimuleren, met in het bijzonder:
- toekenning van het weesgeneesmiddelenstatuut;
- verlaagde of vrijgestelde bijdragen;
- protocolondersteuning tijdens de productontwikkeling;
- bijkomende steunmaatregelen voor KMO's;
- 10 jaar marktexclusiviteit (verlengd met twee jaar wanneer een pediatrisch ontwikkelingsplan binnen een vooropgestelde termijn wordt verwezenlijkt).
Momenteel wordt het uitgewerkte Europese kader opnieuw in vraag gesteld, ondanks de enorme impact, zoals de belangrijke verhoging van het aantal geregistreerde weesgeneesmiddelen bij het EMA (+190 in 11 jaar) en klinische studies voor zeldzame ziekten (+88% tussen 2006 en 2016).
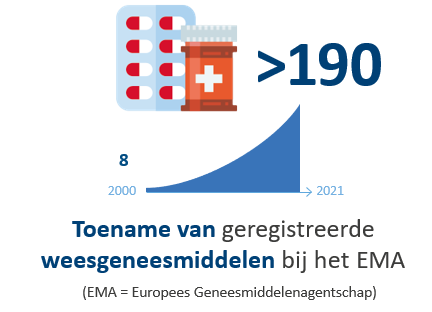
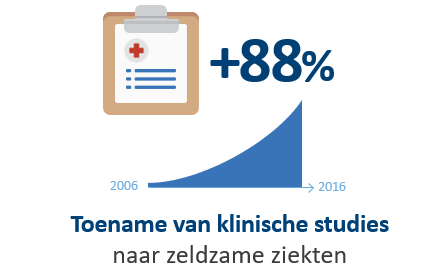
pharma.be is een groot voorstander van het behoud van de Europese regelgeving, die volgens haar essentieel is om het onderzoek en de ontwikkeling van innoverende behandelingen aan te moedigen. In de afgelopen 21 jaar heeft de Europese verordening er voor gezorgd dat er enorme vorderingen werden gemaakt in de ontwikkeling en de beschikbaarheid van weesgeneesmiddelen voor veel patiënten.
Een Belgisch regelgevingskader met specifieke stimulansen voor weesgeneesmiddelen
Ook ons land heeft nationale stimuleringsmaatregelen genomen om Belgische patiënten toegang te geven tot weesgeneesmiddelen, waaronder
- een lagere belasting op geneesmiddelen, met de mogelijkheid de status van weesgeneesmiddel uit te breiden;
- een vrijstelling van de subsidiaire heffing.
Het bestaan van een duidelijk regelgevend kader voor medische noodprogramma's en programma's voor gebruik in schrijnende gevallen is ook van cruciaal belang voor een snelle toegang tot weesgeneesmiddelen voor patiënten in ons land. Ongeveer een derde van de medische noodprogramma's of programma's voor gebruik in schrijnende gevallen die sinds 2014 door het federaal geneesmiddelenagentschap zijn goedgekeurd, heeft betrekking op zeldzame ziekten.
Een Belgisch Plan voor zeldzame ziekten
In december 2013 heeft België een nationaal plan voor zeldzame ziekten uitgewerkt en dit na overleg en in samenwerking met tal van actoren binnen de sector: patiënten, gezondheidsprofessionelen, overheden en de farmaceutische industrie. Dit eerste Belgisch Plan voor zeldzame ziekten definieert twintig actiepunten in vier domeinen:
- Verbeterde toegang tot diagnostiek en informatie;
- Optimalisatie van de zorg;
- Kennis- en informatiebeheer;
- Governance en duurzaamheid.
pharma.be ondersteunt een voortdurende evaluatie en controle van de uitvoering van de verschillende acties, in overleg met de belanghebbenden.
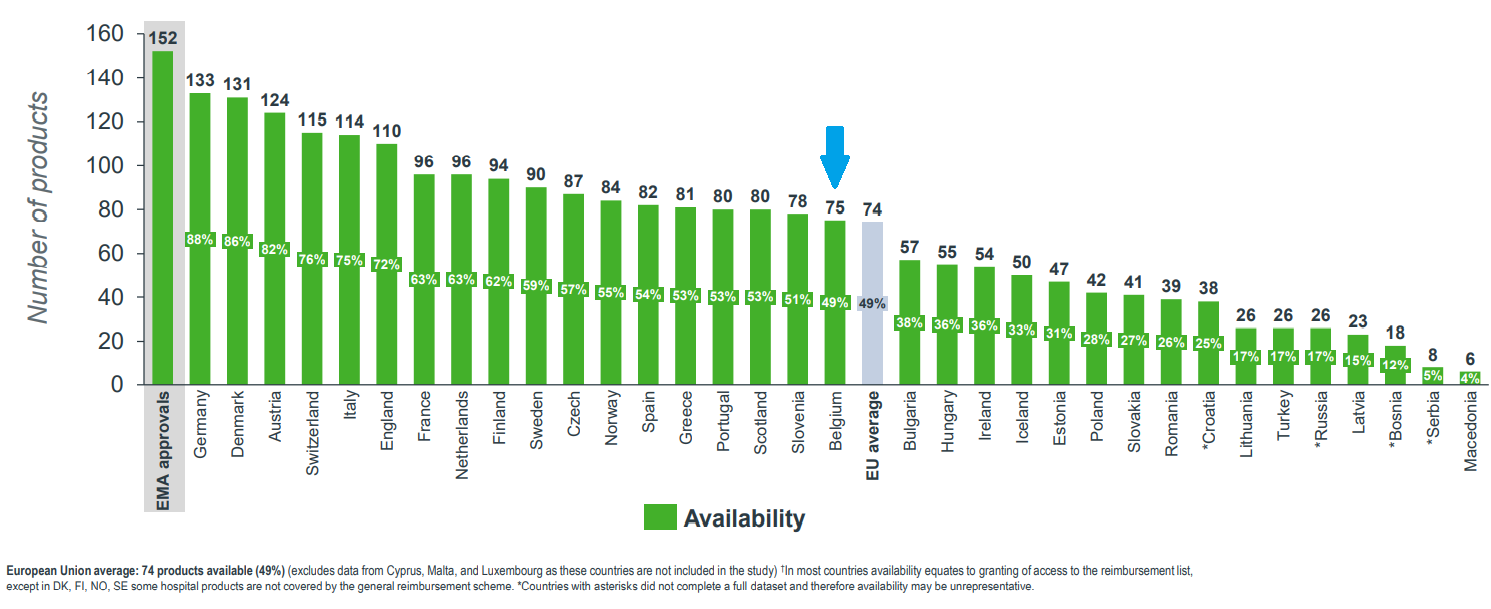
Op Europees vlak situeert België zich momenteel in de middenmoot van het peloton voor wat toegankelijkheid betreft en kan dus op dat vlak zeker nog een tandje bijsteken (WAIT Indicator 2020). Concrete cijfers bevestigen deze stelling aangezien van de 47 weesgeneesmiddelen die tussen 2016 en 2019 door het Europese geneesmiddelenagentschap (EMA) werden goedgekeurd, slechts 18 (38%) ervan op 1 januari 2020 werden terugbetaald.
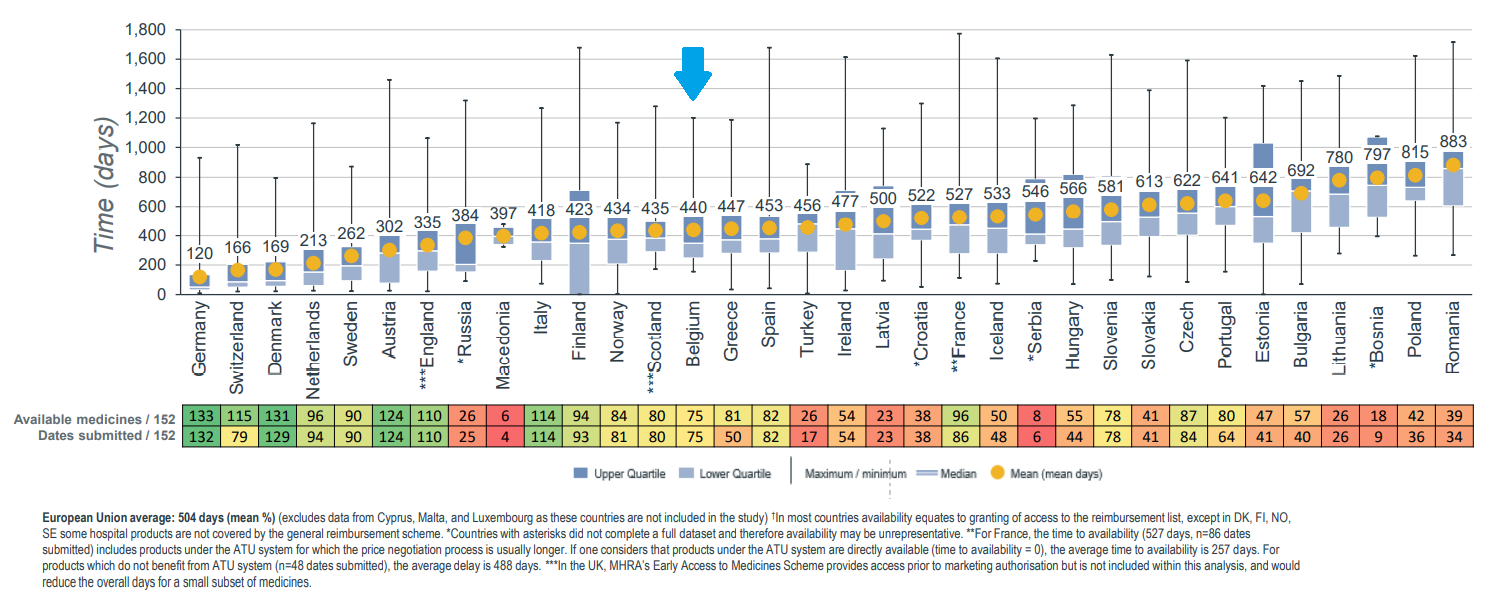
Verder bedroeg de gemiddelde tijd tussen de vergunning voor het in de handel brengen en de vergoeding 528 dagen voor België.
Wat we willen
- Een snelle toegang tot weesgeneesmiddelen verzekeren
- Een ecosysteem van gezondheidsgegevens ontwikkelen
- Optimale testing voor diagnose van zeldzame ziekten
- Optimale behandeling en opvolging van patiënten
[1] EURORDIS
[2] Koning Boudewijnstichting (2015): “ZOOM Zeldzame ziekten: nieuwe perspectieven op gelijke kansen

Schrijf je in op onze nieuwsbrief
Wil je op de hoogte blijven van het reilen en zeilen binnen de farma-industrie, schrijf je dan in op onze nieuwsbrief!