
Maladies rares et médicaments orphelins
Qu’est-ce qu’une maladie rare ?
Selon la définition européenne, une maladie est considérée comme rare lorsqu’elle touche moins d’une personne sur 2.000. En Belgique, cela signifie donc un maximum de 5.500 patients par maladie. Mais rare ne veut cependant pas dire que cela ne concerne qu’un petit nombre de gens. D’après les estimations, il existe quelque 7.000 maladies rares dans le monde, qui touchent environ 350 millions de personnes [1]. Il n’existe pas de chiffres précis pour la Belgique, mais cela tourne autour de quelques centaines de milliers d’individus. La plupart des maladies rares ont une origine génétique et touchent à 75% les enfants [2]. Elles représentent donc indéniablement une question majeure de santé publique.
Les médicaments orphelins, un défi pour les entreprises innovantes
Bien que quelque 500.000 belges soient atteints d’une maladie rare, seuls 5% des maladies rares disposent aujourd’hui d’un traitement médicamenteux enregistré. On note d’ailleurs que 35% des programmes médicaux d’urgence ou d’usage compassionnel concernent les médicaments orphelins. Mais les défis de la recherche pour les maladies rares sont nombreux et complexes...
Ces éléments appellent à la nécessité d’un cadre régulatoire spécifique pour les médicaments orphelins.
Un cadre régulatoire européen efficace, spécifique aux médicaments orphelins
L’Europe a adopté en 2000 des mesures visant à encourager la recherche, le développement et la commercialisation des médicaments orphelins, avec en particulier :
- l’attribution d'une désignation orpheline ;
- des contributions réduites/exonérées ;
- un soutien au protocole lors du développement du produit ;
- des mesures de soutien supplémentaires pour les PME ;
- 10 ans d’exclusivité commerciale (plus 2 ans lorsqu’un plan de développement pédiatrique est finalisé à temps).
A ce jour, le cadre établi au niveau européen est remis en question, malgré son impact majeur, telle l’augmentation significative des médicaments orphelins enregistrés auprès de l’EMA (+190 en 11 ans) et des études cliniques sur les maladies rares (+88% entre 2006 et 2016).
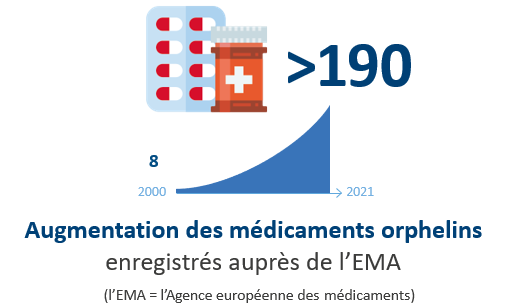
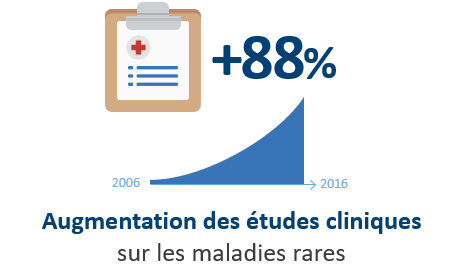
pharma.be soutient fermement le maintien de la réglementation européenne, qu’elle estime indispensable pour encourager la recherche et le développement de traitements innovants. Le règlement européen a permis, au cours des 21 dernières années, des avancées majeures dans le développement et la disponibilité des médicaments orphelins pour de nombreux patients.
Un cadre régulatoire belge offrant des incitants spécifiques aux médicaments orphelins
Notre pays a pris également des mesures incitatives nationales, pour permettre aux patients belges d’accéder aux médicaments orphelins, notamment :
- une taxe sur les médicaments réduite, avec la possibilité de prolonger le statut de médicament orphelin ;
- une exemption du prélèvement subsidiaire.
L'existence d’un cadre réglementaire clair pour les programmes médicaux d’urgence et les programmes d’usage compassionnel est également crucial pour l’accès rapide aux médicaments orphelins pour les patients dans notre pays. Environ un tiers des programmes médicaux d’urgence ou d’usage compassionnel approuvés par l’agence fédérale du médicament depuis 2014 visent des maladies rares.
Un Plan belge pour les maladies rares
En décembre 2013, la Belgique a élaboré un Plan national pour les maladies rares, après consultation et avec la coopération de nombreux acteurs du secteur : patients, professionnels de la santé, pouvoirs publics ainsi que les entreprises pharmaceutiques. Ce premier Plan belge pour les maladies rares définit vingt actions, regroupées en quatre domaines :
- Amélioration de l’accès au diagnostic et à l’information ;
- Optimalisation des soins ;
- Gestion de la connaissance et de l’information ;
- Gouvernance et durabilité.
pharma.be soutient une évaluation et un suivi continu de la mise en œuvre des différentes actions, en concertation avec les parties prenantes.
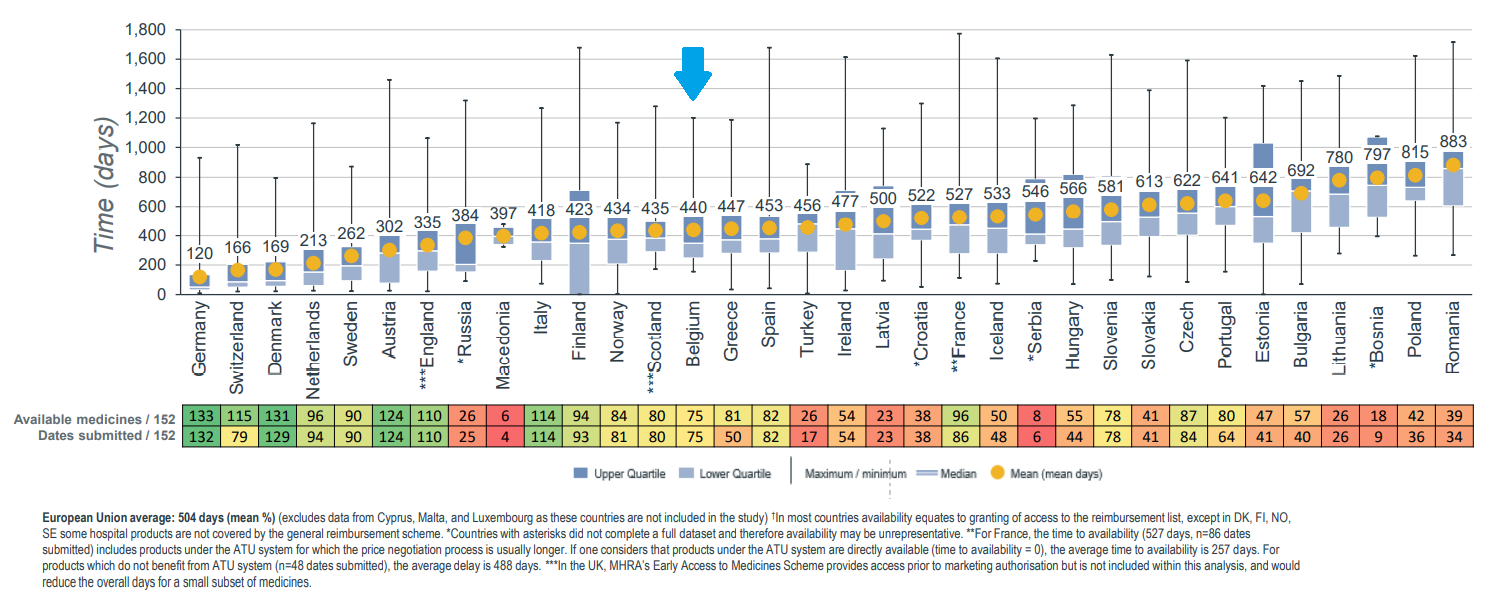
En Europe, la Belgique se situe à ce jour en milieu de peloton en termes d’accessibilité et peut donc encore mieux faire (WAIT Indicator 2020). Des chiffres concrets illustrent cette affirmation, puisque sur les 47 médicaments orphelins approuvés par l'Agence européenne du Médicament (EMA) entre 2016 et 2019, seuls 18 (38%) étaient remboursés en Belgique le 1er janvier 2020 :
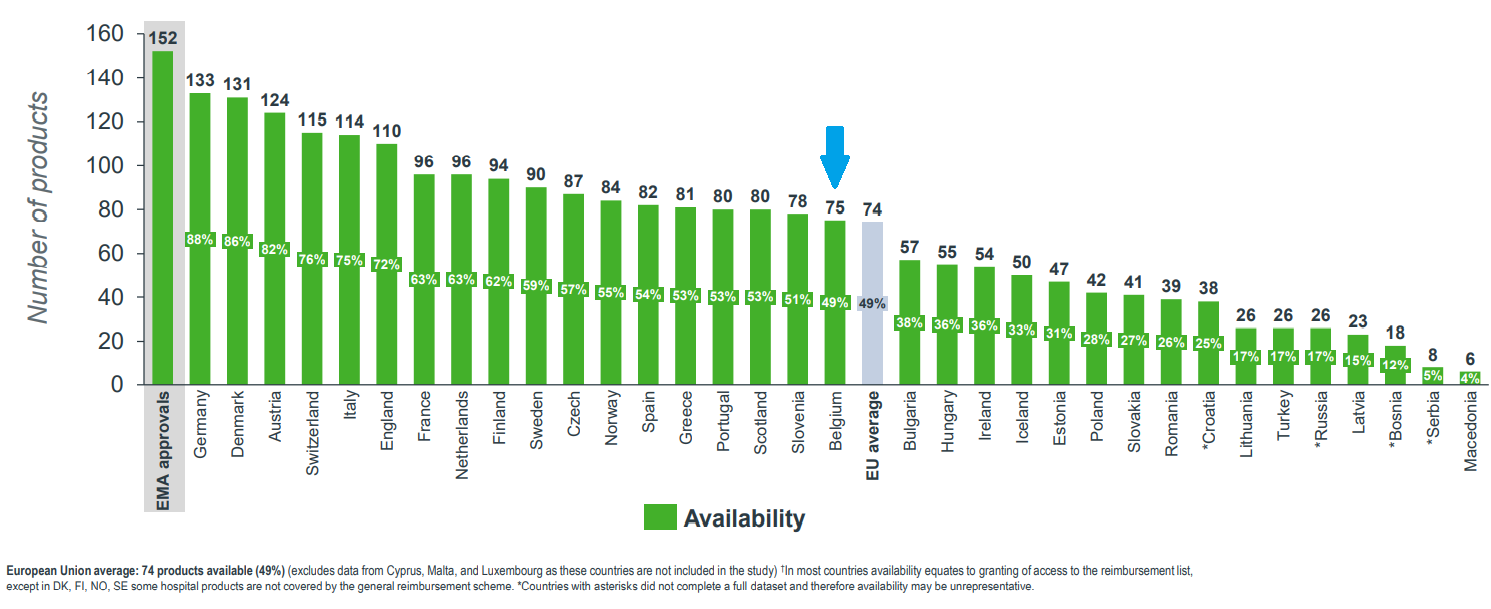
De même, le délai moyen entre l’autorisation de mise sur le marché et le remboursement était de 528 jours pour la Belgique.
Ce que nous souhaitons
- Assurer un accès rapide aux médicaments
- Développer un écosystème de données de santé
- Optimiser l'accès aux tests de diagnostic des maladies rares
- Optimiser le traitement et le suivi des patients
[1] EURORDIS
[2] Fondation Roi Baudoin (2015): “ZOOM Zeldzame ziekten: nieuwe perspectieven op gelijke kansen

Intéressé(e) à recevoir les nouvelles de pharma.be
Etre au courant de ce qui vit au sein de l'industrie pharmaceutique ? Inscrivez-vous à notre lettre d'information.