
La Belgique doit préserver son écosystème solide en faveur des études cliniques en oncologie
La Belgique reste un leader européen en recherche clinique oncologique, mais cette position se fragilise. Pour garantir l’accès des patients aux innovations et préserver un écosystème d’excellence reconnu, il est essentiel de maintenir et renforcer l’attractivité de notre pays. Le nouveau plan national contre le cancer offre une occasion unique d'élaborer et de mettre en œuvre une stratégie ambitieuse et globale à cet effet.
La Belgique conserve une position de leader dans l'UE en matière d'essais cliniques, mais elle est fragile
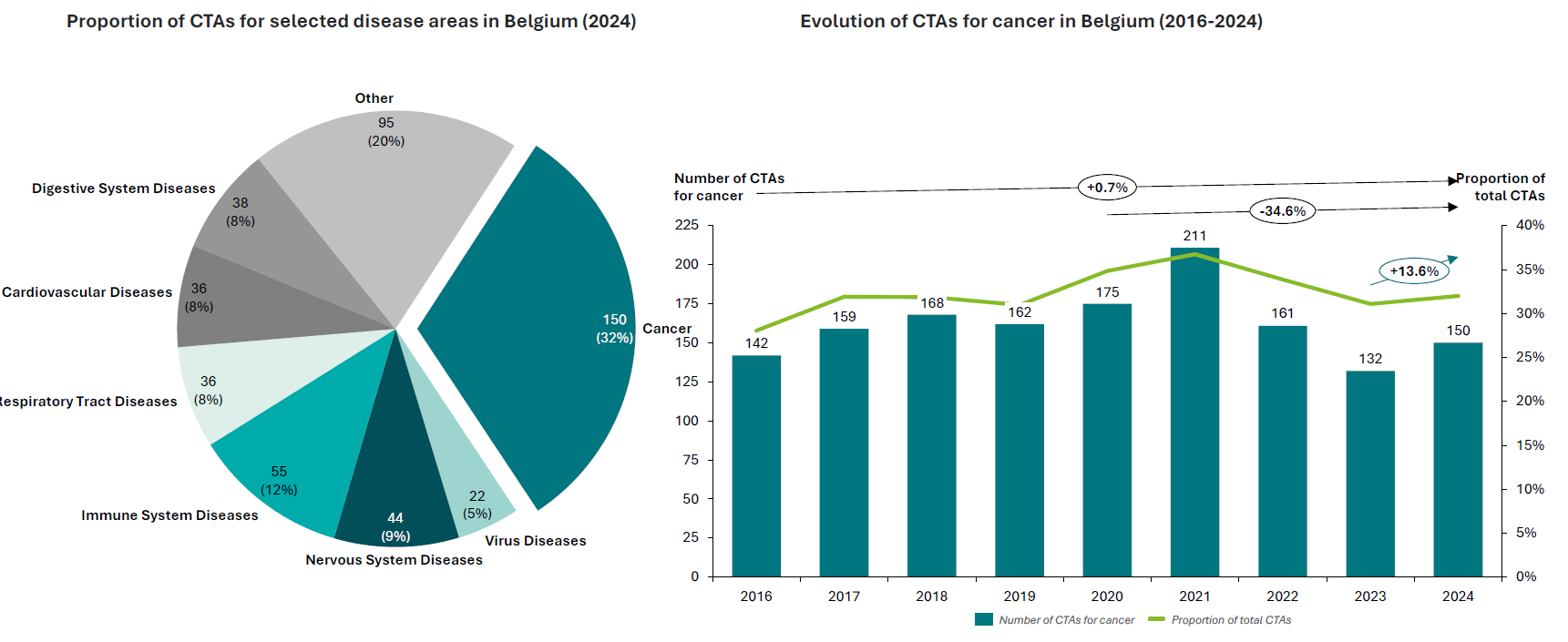
Un récent rapport réalisé par Deloitte pour pharma.be montre qu'en 2024, la Belgique conserve sa position parmi les leaders européens en termes de nombre d'essais cliniques autorisés par habitant. Il note toutefois une légère baisse du nombre d'autorisations au cours des huit dernières années en Belgique (-1,1 %) et que, bien que la Belgique soit toujours en tête, d'autres États membres tels que les Pays-Bas rattrapent leur retard. De plus, l'Europe en général perd du terrain dans le domaine de la recherche clinique.
En 2024, 32 % des essais autorisés en Belgique sont des essais en oncologie, ce qui illustre l'expertise de la Belgique dans ce domaine ; 17 % des essais en oncologie menés en Europe le sont en Belgique, ce qui confirme la forte présence du pays en Europe.
Cet écosystème solide pour les études cliniques en oncologie en particulier (avec une prise en charge du cancer de haute qualité, des infrastructures de pointe et des leaders d'opinion clés parmi les chercheurs) doit être préservé et notre position de leader doit être maintenue et, si possible, améliorée. L'attractivité de notre pays pour la recherche clinique est cruciale pour permettre aux patients belges d'accéder aux dernières innovations susceptibles de leur sauver la vie et pour renforcer notre expertise clinique sur le sol belge.
Un cadre réglementaire flexible est indispensable pour les essais cliniques combinés
Les essais cliniques combinant l'expérimentation d'un nouveau médicament et un diagnostic in vitro sont de plus en plus fréquents dans le domaine de l'oncologie. Ces « études combinées » sont complexes à évaluer car elles impliquent différentes législations qui ne sont pas harmonisées. Cela entraîne des retards dans le lancement de ces essais et dans l'accès futur à des médicaments innovants en oncologie. L'Agence fédérale belge des médicaments et des produits de santé (AFMPS) a annoncé en janvier 2026 la mise en place d'une procédure simplifiée et harmonisée pour l'évaluation de ces études combinées afin de faciliter leur évaluation et, par conséquent, leur lancement en Belgique.
Investir dans les données du monde réel (RWD) pour maintenir les essais cliniques en Belgique
Une utilisation optimale des données de haute qualité est un facteur clé pour améliorer l'efficacité à toutes les étapes du développement clinique. L'accès aux données réelles, via l'Agence des données de santé par exemple, dans le but d'optimiser l'évaluation de la faisabilité des études ainsi que l'identification et le recrutement des patients, et ainsi de garantir des délais de démarrage rapides et prévisibles, permettra à la Belgique de se positionner comme un pays favorable.
En outre, les données pourraient faciliter l'utilisation de nouvelles technologies dans les essais cliniques afin de positionner la Belgique comme un pays pionnier en matière d'innovation. Par conséquent, et comme le stipule l'accord du gouvernement fédéral belge, nous mettons en place un système de partage des données conforme au Règlement Général sur la Protection des Données (RGPD) et compatible avec l'espace européen des données de santé (EHDS), afin que le partage fluide et sécurisé des données soit le fondement de soins coordonnés et intégrés, y compris la recherche clinique. L'ambition européenne en matière de partage des données et de technologie d'IA (loi sur l'IA) vise à placer l'Europe à la pointe de l'innovation dans les secteurs technologiques essentiels dans l'économie de demain (Compas de compétitivité de la Commission européenne). En conséquence, plusieurs pays européens investissent activement dans les infrastructures et les technologies de données afin de réutiliser des données réelles plus qualitatives dans la recherche et les soins de santé. De plus, l'autorité réglementaire européenne de premier plan, l'Agence européenne des médicaments (EMA), utilise les données du monde réel (RWD) dans le cadre de la poursuite de ses objectifs statutaires, tels que la facilitation du développement et de l'accès aux médicaments.
Le développement d'un réseau national d'essais cliniques comprenant un réseau de données et reliant les centres cliniques permettrait une coordination centrale de la faisabilité des études et de la localisation des patients, et garantirait ainsi un recrutement efficace des patients (une faiblesse du paysage belge en matière d'essais cliniques). Un tel réseau s'appuierait également sur l'échange d'expertise entre les sites cliniques et les chercheurs, une expertise particulièrement reconnue comme un atout pour notre pays et qui devrait être davantage mise à profit. Cela doit donc être l'une des actions prioritaires du nouveau plan national contre le cancer et de sa stratégie ambitieuse et globale en matière de données et de recherche clinique. La Belgique pourra ainsi conserver sa position de leader en matière d’études cliniques en oncologie.



Intéressé(e) à recevoir les nouvelles de pharma.be
Etre au courant de ce qui vit au sein de l'industrie pharmaceutique ? Inscrivez-vous à notre lettre d'information.


