
pharma.be roept op om de toegang tot weesgeneesmiddelen te verbeteren in België
Zoals blijkt uit de meest recente WAIT indicator analyse die EFPIA jaarlijks publiceert, is de toegang tot nieuwe geneesmiddelen in België middelmatig. Als we meer specifiek inzoomen op de toegang tot weesgeneesmiddelen is de situatie alarmerend. Slechts 35 % van de 63 recent goedgekeurde weesgeneesmiddelen wordt in België terugbetaald. Dit is 15 % lager dan zes jaar geleden.
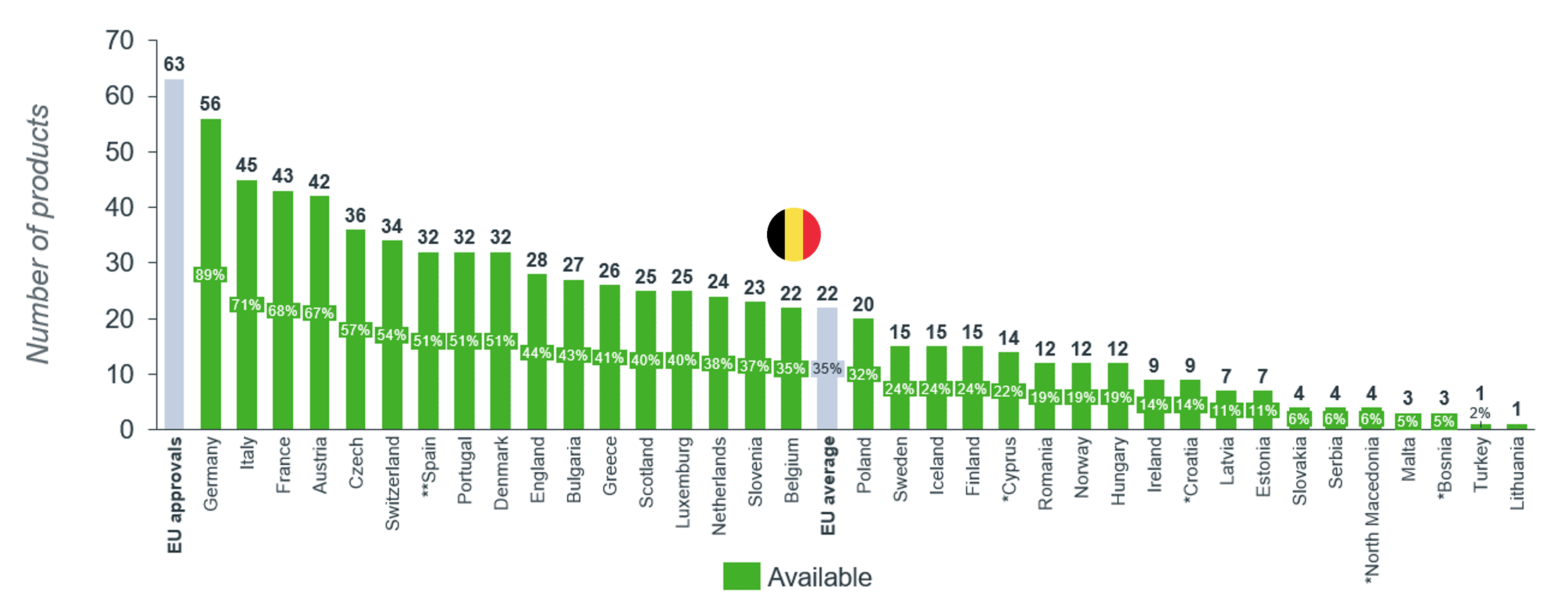
pharma.be heeft de terugbetalingsdossiers voor weesgeneesmiddelen van haar leden in 2023 onder de loep genomen. Deze analyse betreft dus enkel geneesmiddelen die door de Commissie Tegemoetkoming Geneesmiddelen (CTG) werden geëvalueerd.
In 2023 werden 18 dossiers voor weesgeneesmiddelen van 16 verschillende bedrijven in uiteenlopende therapeutische domeinen door de CTG geëvalueerd:
- antineoplasie en immunomodulerende stoffen (ATC-L) (n=7)
- zenuwstelsel (ATC-N) (n=4)
- spijsvertering en metabolisme (ATC-A) (n=3)
- hormonale preparaten (ATC-H) (n=2)
- anti-infectiemiddelen (ATC-J) (n=1)
- bewegingsapparaat (ATC-M) (n=1)
Slechts de helft van deze ingediende dossiers resulteerde in een terugbetaling (9/18). Dit is aanzienlijk lager dan de toegang die in 2023 werd verleend aan andere innovatieve geneesmiddelen (ongeveer 70 %).
In 40 % van deze dossiers heeft het bedrijf meer dan één poging ondernomen om terugbetaling aan te vragen door opnieuw een dossier in te dienen bij de CTG, waardoor de wachttijd tot terugbetaling hoog ligt.
Volgens de WAIT indicator van EFPIA moeten patiënten in België gemiddeld 613 dagen wachten op de terugbetaling van een weesgeneesmiddel. Bedrijven dienen gemiddeld vijf maanden na EMA-goedkeuring van het weesgeneesmiddel een terugbetalingsdossier in België in [1]. Er blijven dus gemiddeld ongeveer 450 a 500 dagen over voor de terugbetalingsprocedure. Als men de schorsingen tijdens de CTG-procedure niet meetelt, duurt de terugbetalingsprocedure gemiddeld 250 dagen [2].
Deze resultaten zijn verontrustend omdat het geneesmiddelen betreft voor zeldzame, vaak moeilijk te behandelen ziekten. Vandaag bestaat er een behandeling voor slechts 6 % van de zeldzame ziekten [3]. Hoewel deze ziekten soms weinig gekend zijn en het aantal patiënten zeer laag ligt, blijven farmaceutische bedrijven in onderzoek en ontwikkeling van weesgeneesmiddelen investeren dankzij stimulansen in het Europees wetgevend kader, en bestaat 30 % van de geneesmiddelen in ontwikkeling uit weesgeneesmiddelen [4]. Om een snelle en brede terugbetaling van weesgeneesmiddelen te bevorderen pleit pharma.be ervoor om:
- Specifieke procedures te ontwikkelen die toelaten een vroege, snelle maar tijdelijke terugbetaling mogelijk te maken voor veelbelovende geneesmiddelen in afwachting van een klassieke evaluatie en terugbetaling, vergelijkbaar met wat bestaat in andere performante landen.
- Terugbetalingsovereenkomsten te blijven gebruiken als middel om nieuwe weesgeneesmiddelen met klinische en/of budgettaire onzekerheden in België terug te betalen voor patiënten
- Naast de klassieke klinische studies ook de waarde van “real-world evidence” als bron van evidentie ten volle te erkennen evenals andere vormen van studies wanneer klassieke klinische studies niet of nog niet mogelijk zijn, zoals bijvoorbeeld klinische studies met intermediaire eindpunten (tussentijdse klinische resultaten).
- Werk te maken van de implementatie van de aanbevelingen voor prioritaire acties geformuleerd door het Fonds Zeldzame Ziekten en Weesgeneesmiddelen van de Koning Boudewijnstichting in februari 2022, om een optimale behandeling te verzekeren van patiënten die lijden aan een zeldzame ziekte, inbegrepen via de terugbetaling van weesgeneesmiddelen.

[1] Bron: RIZIV
[2] Bron: RIZIV
[3] Bron: https://www.eurordis.org/rare-disease-policy/european-policy/
[4] Bron: Global Trends in R&D 2023: Activity, Productivity and Enablers. IQVIA, Feb 2023

Schrijf je in op onze nieuwsbrief
Wil je op de hoogte blijven van het reilen en zeilen binnen de farma-industrie, schrijf je dan in op onze nieuwsbrief!


