
pharma.be appelle à améliorer l'accès aux médicaments orphelins en Belgique
Comme le montre la dernière analyse de l'indicateur WAIT publiée annuellement par l'EFPIA, l'accès aux nouveaux médicaments en Belgique est médiocre. Si l'on se penche plus spécifiquement sur l'accès aux médicaments orphelins, la situation est alarmante. Seuls 35 % des 63 médicaments orphelins récemment approuvés sont remboursés en Belgique. C'est 15 % de moins qu'il y a six ans.
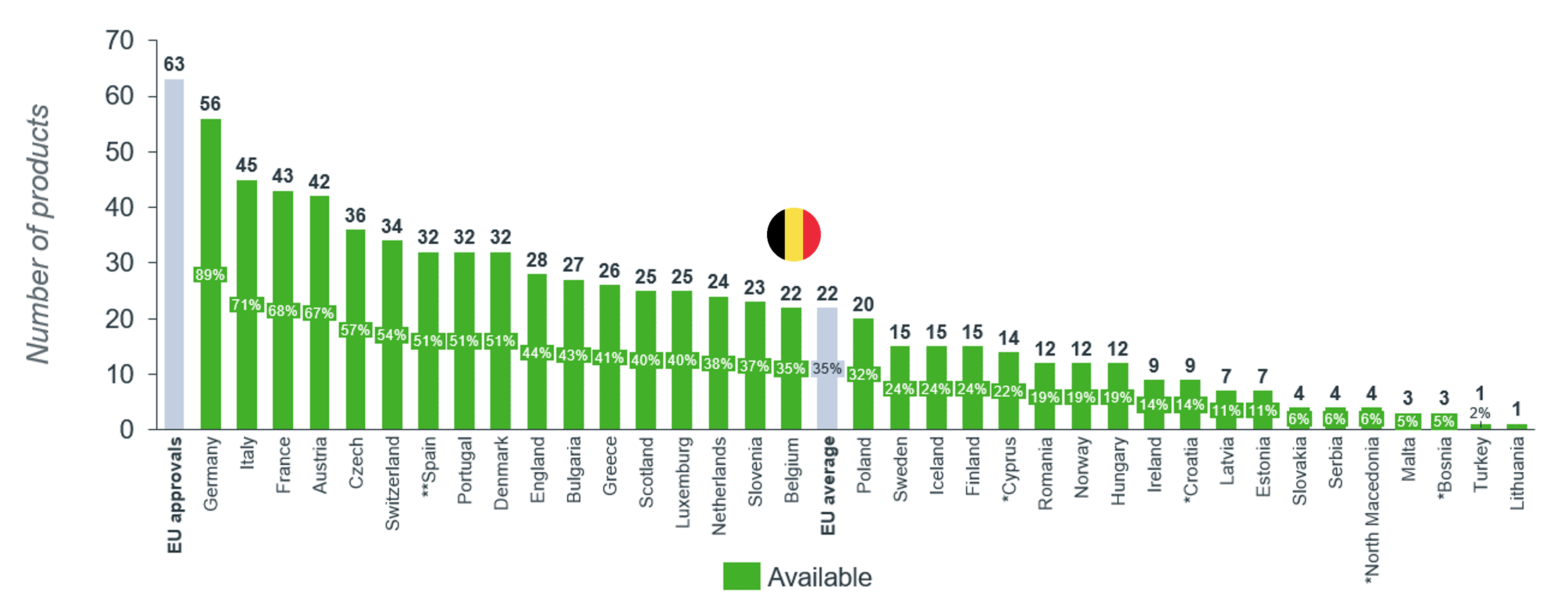
pharma.be a examiné les dossiers de remboursement des médicaments orphelins 2023 de ses membres. Cette analyse ne porte donc que sur les médicaments qui ont été évalués par la Commission de remboursement des médicaments (CRM).
En 2023, 18 dossiers de médicaments orphelins provenant de 16 entreprises différentes ont été évalués par la CRM, dans divers domaines thérapeutiques :
- agents antinéoplasiques et immunomodulateurs (ATC-L) (n=7)
- système nerveux (ATC-N) (n=4)
- digestion et métabolisme (ATC-A) (n=3)
- préparations hormonales (ATC-H) (n=2)
- anti-infectieux (ATC-J) (n=1)
- appareil musculo-squelettique (ATC-M) (n=1).
Seule la moitié de ces demandes a donné lieu à un remboursement (9/18). Ce chiffre est nettement inférieur à l'accès accordé à d'autres médicaments innovants en 2023 (environ 70 %).
Dans 40 % de ces cas, l'entreprise a fait plus d'une tentative pour demander un remboursement en déposant une nouvelle demande auprès de la CRM, ce qui a entraîné un temps d'attente élevé pour le remboursement.
D’après l’indicateur WAIT de l’EFPIA, les patients doivent attendre en moyenne 613 jours pour obtenir le remboursement d'un médicament orphelin en Belgique. Les entreprises soumettent un dossier de remboursement en Belgique en moyenne 5 mois après l'approbation du médicament orphelin par l'EMA [1]. Cela laisse en moyenne 450 à 500 jours pour la procédure de remboursement. Si l'on ne tient pas compte des suspensions pendant la procédure CRM, la procédure de remboursement prend en moyenne 250 jours [2].
Ces résultats sont inquiétants car ils concernent des médicaments pour des maladies rares, souvent difficiles à traiter. Aujourd'hui, il n'existe des traitements que pour 6 % des maladies rares [3]. Bien que ces maladies soient parfois peu connues et que le nombre de patients soit très faible, les entreprises pharmaceutiques continuent d'investir dans la recherche et le développement de médicaments orphelins grâce aux incitations du cadre législatif européen, et 30% des médicaments en développement sont des médicaments orphelins [4]. Pour favoriser un remboursement rapide et généralisé des médicaments orphelins, pharma.be préconise :
- développer des procédures spécifiques permettant un remboursement précoce, rapide mais temporaire des médicaments prometteurs dans l'attente d'une évaluation et d'un remboursement classiques, à l'instar de ce qui existe dans d'autres pays performants.
- continuer à utiliser les conventions de remboursement comme moyen de rembourser les nouveaux médicaments orphelins présentant des incertitudes cliniques et/ou budgétaires pour les patients en Belgique
- en plus des études cliniques classiques, reconnaître pleinement la valeur des "données du monde réel" en tant que source de données ainsi que d'autres formes d'études lorsque les études cliniques classiques ne sont pas ou pas encore possibles, telles que, par exemple, les études cliniques avec des critères intermédiaires (résultats cliniques intermédiaires).
- travailler à la mise en œuvre des recommandations d'actions prioritaires formulées par le Fonds de la Fondation Roi Baudouin pour les maladies rares et les médicaments orphelins en février 2022, afin d'assurer un traitement optimal des patients souffrant d'une maladie rare, y compris par le remboursement des médicaments orphelins.

[1] Source : INAMI
[2] Source : INAMI
[3] Source : https://www.eurordis.org/fr/politique-sur-les-maladies-rares/politique-europeenne/
[4] Source : Global Trends in R&D 2023: Activity, Productivity and Enablers. IQVIA, Feb 2023

Intéressé(e) à recevoir les nouvelles de pharma.be
Etre au courant de ce qui vit au sein de l'industrie pharmaceutique ? Inscrivez-vous à notre lettre d'information.


