
Hoe kan België de toekomstige overgang van papieren naar elektronische geneesmiddeleninformatie voorbereiden?
De Europese farmaceutische wetgeving ondergaat momenteel een herziening, waarbij de introductie van elektronische patiëntenbijsluiters een van de onderwerpen is. Om deze digitale evolutie goed voor te bereiden, is pharma.be geïnteresseerd in het verkennen van de mogelijkheid voor een bijkomend pilootproject met elektronische bijsluiters buiten de ziekenhuisomgeving, met name voor geneesmiddelen toegediend door zorgverleners, zoals vaccins. Een open dialoog met alle betrokken belanghebbenden is hierbij cruciaal om de verschillende noden in kaart te brengen.
Een herziening van de Europese farmaceutische wetgeving
De huidige Europese regelgeving vereist dat de patiëntenbijsluiter verplicht aanwezig is in elke geneesmiddelenverpakking. Daarnaast is een elektronische versie beschikbaar via diverse betrouwbare bronnen, zoals de databank van het Federaal Agentschap voor geneesmiddelen en gezondheidsproducten (FAGG), de website van het Belgisch Centrum voor Farmacotherapeutische Informatie (BCFI) of de pharma.be e-compendium website.
Momenteel voorziet de Europese Unie in een herziening van de farmaceutische wetgeving. In dit herenigingsproces wordt het concept van het elektronische formaat voor patiëntenbijsluiters geïntroduceerd in het originele voorstel van de Europese Commissie. Er wordt overwogen om over te stappen van papieren bijsluiters naar elektronische bijsluiters, waarbij op nationaal niveau ruimte wordt gelaten voor de (stapsgewijze) implementatie hiervan, zoals bijvoorbeeld op basis van de afleveringswijze van geneesmiddelen. Belangrijk is dat patiënten te allen tijde het recht behouden om een papieren bijsluiter te vragen, zelfs als deze alleen elektronisch beschikbaar zou zijn.
Op 10 april 2024 heeft het Europees Parlement gestemd over zijn positie over deze herziening van de wetgeving. In deze positie wordt benadrukt dat lidstaten kunnen beslissen of de bijsluiter zowel in papieren als elektronische vorm beschikbaar moet worden gesteld, of alleen elektronisch. Deze beslissing vereist wel raadpleging van patiënten, verzorgers en andere relevante belanghebbenden. Als er geen specifieke regels zijn, geldt de standaardoptie van zowel elektronische als papieren bijsluiters. Er wordt echter een uitzondering gemaakt voor producten die verstrekt en toegediend worden door zorgverleners, zoals artsen of apothekers, waarbij deze raadpleging van belanghebbenden niet vereist is.
Hoewel het Europees Parlement zijn positie heeft ingenomen, is het belangrijk op te merken dat het proces nog niet is afgerond. Momenteel wordt de positie van de Europese Raad afgewacht, waarna verdere discussies tussen de Commissie, het Parlement en de Raad kunnen plaatsvinden.
De elektronische bijsluiter, een gelijkwaardig alternatief voor de papieren bijsluiter voor geneesmiddelen toegediend in het ziekenhuis
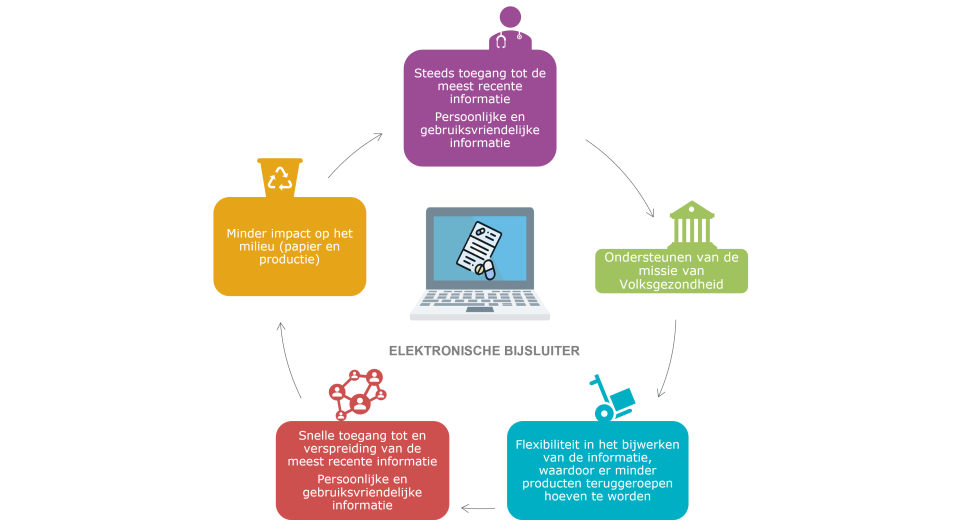
Elektronische productinformatie biedt een reeks van voordelen ten opzichte van de papieren bijsluiter, zoals steeds toegang tot de meeste recente versie van de bijsluiter, en dus de laatste informatie over de veiligheid van het product, de mogelijkheid deze raad te plegen in een groter lettertype, gemakkelijk doorzoekbaar en milieuvriendelijk. In 2018 werd het e-PIL pilootproject gelanceerd in België en Luxemburg (pionier in Europa) op initiatief van de farmaceutische industrie en met de ondersteuning van de Europese en nationale bevoegde autoriteiten en de associaties van de ziekenhuisapothekers. Het doel van het project is om aan te tonen dat de elektronische bijsluiter gelijkwaardig is aan de papieren bijsluiter om patiënten en zorgverleners in de ziekenhuisomgeving informatie te verstrekken over een veilig en doeltreffend gebruik van de geneesmiddelen. De tussentijdse resultaten van dit project zijn zeer positief, en men kan stellen dat de gelijkwaardigheid in de ziekenhuisomgeving werd aangetoond.
De elektronische bijsluiter, ook een gelijkwaardig alternatief voor geneesmiddelen toegediend door zorgverleners, buiten de ziekenhuisomgeving?
pharma.be is geïnteresseerd in het verkennen van de mogelijkheid voor een pilootproject met elektronische bijsluiters buiten de ziekenhuisomgeving, met name voor geneesmiddelen toegediend door zorgverleners, zoals vaccins. Een dergelijk initiatief is in lijn met het voorstel in de positie van het Europees parlement met betrekking tot de herziening van de Europese wetgeving (zie hierboven), en een opportuniteit om de toekomstige overgang van papieren naar elektronische patiëntenbijsluiters in België voor te bereiden.
Uit de resultaten van een artikel van Martina Bamberger uit 2022 over “Replacing vaccine paper package inserts: a multi country questionnaire study on the acceptability of an electronic replacement in different target groups” blijkt dat de papieren bijsluiters van vaccins vandaag de dag zelden worden gebruikt en vaak niet beschikbaar zijn voor de gevaccineerde. In de onderzochte landen zou de meerderheid van de gevaccineerden een elektronische versie van de bijsluiter accepteren. Het overschakelen op elektronische bijsluiters van vaccins zou een aanvaardbaar alternatief zijn voor het publiek, waarbij mogelijks de kwaliteit alsook de hoeveelheid informatie die de gevaccineerde bereikt, toeneemt, terwijl een aantal belemmeringen voor de herdistributie van vaccins tussen landen zou worden weggenomen, wat de beschikbaarheid van vaccins ten goede komt.
Een belangrijk dialoog met alle betrokken belanghebbenden
pharma.be streeft naar een open dialoog met alle betrokken belanghebbenden om de mogelijkheden van elektronische patiëntenbijsluiters verder te verkennen. Samenwerking tussen industrie, overheden, zorgverleners en patiënten is essentieel om een soepele overgang naar elektronische productinformatie te waarborgen in de toekomst en tegelijkertijd de behoeften van alle partijen te respecteren.


Schrijf je in op onze nieuwsbrief
Wil je op de hoogte blijven van het reilen en zeilen binnen de farma-industrie, schrijf je dan in op onze nieuwsbrief!


