
De terugbetaling van innovatieve geneesmiddelen kan beter in België
De voortrekkersrol van ons land op het vlak van de ontwikkeling en productie van innovatieve geneesmiddelen vertaalt zich spijtig genoeg niet in een snelle beschikbaarheid van deze innovaties voor de patiënt.
België hinkt achterop in Europa wat terugbetaling betreft
Om België te positioneren binnen Europa, maken we gebruik van gegevens over de terugbetaling in 34 Europese landen, verzameld door de Europese sectorfederatie EFPIA. De Europese W.A.I.T.- indicator 2020 analyseert de terugbetaling van alle geneesmiddelen die tussen 2016 en 2019 door het Europees Geneesmiddelenagentschap (EMA) werden goedgekeurd en die dus in aanmerking komen voor het aanvragen van terugbetaling in de verschillende Europese lidstaten.
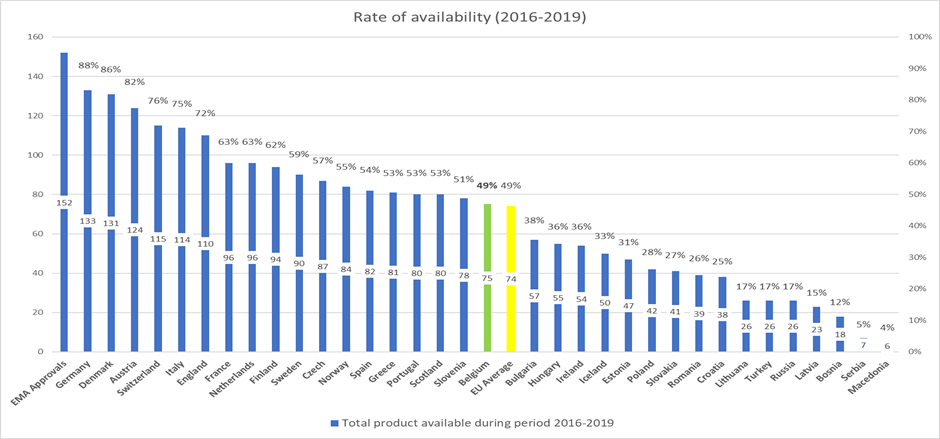
Van de 152 bestudeerde geneesmiddelen waren er eind 2020 slechts 75 terugbetaald in België. Dit betekent dat minder dan de helft (49%) van de geneesmiddelen die een marktvergunning kregen, beschikbaar waren voor Belgische patiënten. Hiermee staan we slechts op de 18de plaats. De verschillen tekenen zich nog scherper af wanneer we vergelijken met grote buurlanden zoals Duitsland en Frankrijk, waar respectievelijk 88% en 64% van de geneesmiddelen terugbetaald zijn.
Dit betekent jammer genoeg dat Belgische patiënten beduidend minder toegang hebben tot innovatieve geneesmiddelen dan patiënten in vergelijkbare Europese landen.
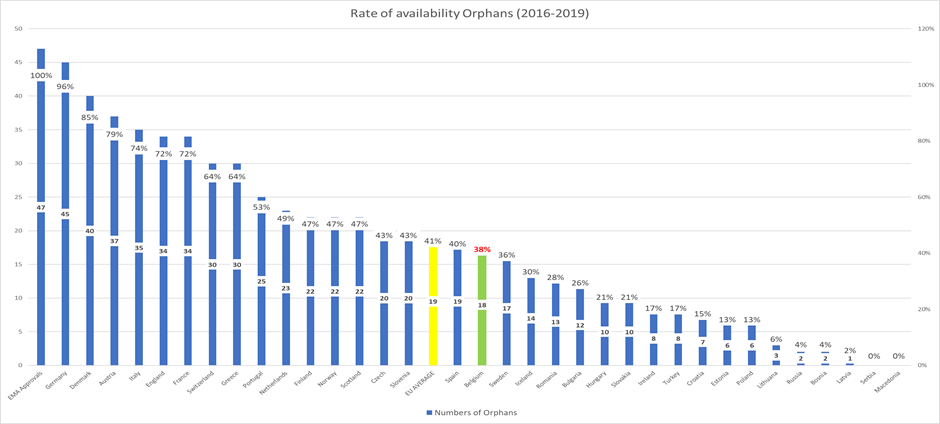
Een gelijkaardige analyse van de geneesmiddelen voor de behandeling van zeldzame ziekten, laat zien dat België onderaan de ranglijst bengelt met slechts 38% van de goedgekeurde weesgeneesmiddelen die in België terugbetaald zijn.
Ongeveer drie op vier terugbetalingsprocedures in België resulteert in effectieve terugbetaling
pharma.be analyseerde de terugbetalingsprocedures bij de Commissie Tegemoetkoming Geneesmiddelen (CTG) over de periode 2018 tot 2020. De analyse heeft betrekking op afgeronde terugbetalingsprocedures met twee mogelijke uitkomsten: ofwel wordt het geneesmiddel terugbetaald en is het vanaf dan beschikbaar voor de patiënt, ofwel wordt de terugbetaling geweigerd. We onderscheiden drie types geneesmiddelen: geneesmiddelen met een therapeutische meerwaarde, weesgeneesmiddelen en nieuwe indicaties.*
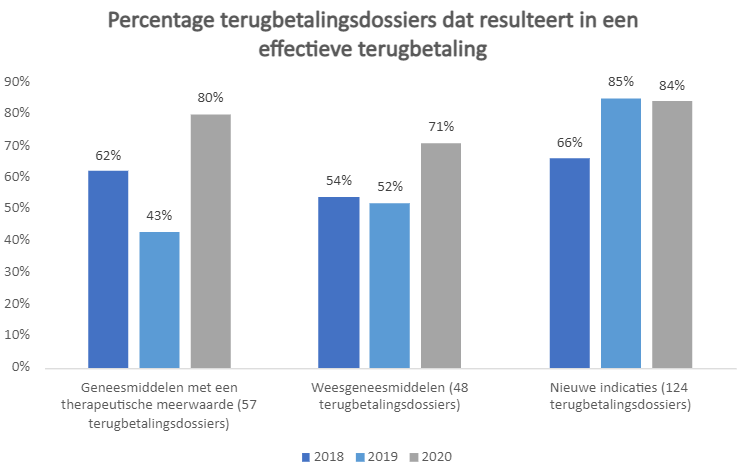
Algemeen leidt ongeveer driekwart van de aanvragen voor terugbetaling van een innovatief geneesmiddel in België tot een effectieve terugbetaling.
De cijfers van 2020 zijn gunstiger maar minder representatief omdat in 2020 omwille van COVID-19 een kwart minder procedures werd doorlopen dan in de twee voorgaande jaren. We focussen daarom op de resultaten van 2018 en 2019.
Geneesmiddelen met een therapeutische meerwaarde en weesgeneesmiddelen hebben het duidelijk moeilijker om terugbetaling te verkrijgen in België. Door de band genomen, werd iets meer dan de helft van de aanvragen voor terugbetaling in 2018 en 2019 goedgekeurd. Voor de andere helft was er geen positieve beslissing; deze geneesmiddelen bleven dus onbeschikbaar voor patiënten.
De terugbetalingsprocedures voor geneesmiddelen voor nieuwe indicaties evolueerden positief. Dit is een gevolg van een nieuwe methode die de CTG sinds juli 2018 hanteert om de nieuwe indicaties van deze geneesmiddelen te evalueren. Deze methode werpt duidelijk zijn vruchten af: in 2019 resulteerde 85% van de aanvragen in een terugbetaling.
Terugbetaling laat te lang op zich wachten
De weg van nieuwe geneesmiddelen van het laboratorium naar de patiënt is zeer lang. Na jaren van klinisch onderzoek en ontwikkeling moet nog een lange administratieve procedure doorlopen worden.
Vooraleer Belgische patiënten er toegang toe krijgen, moeten nieuwe geneesmiddelen een vergunning van het EMA hebben voor het in de handel brengen. Er moet ook een beslissing tot terugbetaling zijn van de Belgische minister van Sociale Zaken. Het EMA heeft maximaal 210 dagen nodig voor een besluit over de Europese marktvergunning. De daaropvolgende nationale terugbetalingsprocedure neemt eveneens verschillende maanden in beslag, zoals blijkt uit onderstaande cijfers:
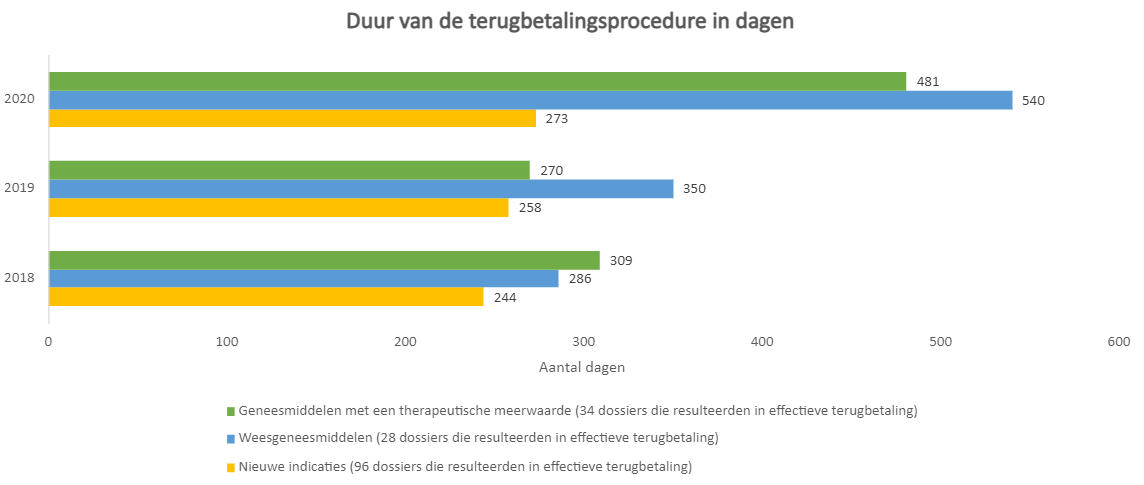
Analyseren we de termijn tussen het indienen van het terugbetalingsdossier bij de CTG en de datum waarop het geneesmiddel effectief terugbetaald is en kan voorgeschreven worden, dan blijkt dat de terugbetalingsprocedure in 2018 en 2019 al snel 8 tot 12 maanden duurde. De uitschieters in 2020 zijn ook hier te verklaren door de impact van COVID-19. Patiënten moeten in België dus veel geduld hebben om behandeld te kunnen worden met innovatieve geneesmiddelen.
* Indicaties
-
Een geneesmiddel met een therapeutische meerwaarde biedt volgens het betrokken farmaceutische bedrijf een hogere therapeutische waarde dan een aanvaarde standaardbehandeling. Dit betekent dat de ziekte met dit geneesmiddel beter behandeld wordt.
-
Een weesgeneesmiddel is een geneesmiddel voor de behandeling van een zeldzame ziekte en biedt daardoor vaak een oplossing voor een onbeantwoorde medische nood.
-
Een nieuwe indicatie verwijst naar een geneesmiddel dat al voor een bepaalde indicatie/aandoening wordt terugbetaald en waarvoor het bedrijf een bijkomende terugbetaling aanvraagt voor een andere indicatie/aandoening. Dat kan bijvoorbeeld een geneesmiddel zijn dat al wordt vergoed voor de behandeling van longkanker maar nu ook wordt terugbetaald voor de behandeling van darmkanker.



Schrijf je in op onze nieuwsbrief
Wil je op de hoogte blijven van het reilen en zeilen binnen de farma-industrie, schrijf je dan in op onze nieuwsbrief!


