
Belgische patiënten wachten op ambitieuze overheid om terugbetaling van geneesmiddelen te verbeteren
Een Europese vergelijking toont dat in België slechts de helft van de vergunde geneesmiddelen terugbetaald zijn. Het is bovendien heel lang wachten op die terugbetaling. Hoog tijd voor de overheid om de terugbetalingsprocedures te moderniseren.
Slechts de helft van de vergunde geneesmiddelen is terugbetaald in België
De Europese sectorfederatie EFPIA publiceert sinds 2004 jaarlijks de Waiting to Access Innovative Therapies of W.A.I.T.-indicator. Dit is een belangrijk instrument om de terugbetaling van innovatieve geneesmiddelen binnen Europa te vergelijken.
De publicatie van de W.A.I.T.-indicator 2021 is een uitstekende gelegenheid om de positie van België binnen Europa opnieuw te evalueren.1 EFPIA verzamelde gegevens over de terugbetaling in 39 Europese landen van de 160 geneesmiddelen die tussen 2017 en 2020 door het Europees Geneesmiddelenagentschap (EMA) werden goedgekeurd. Dit zijn dus geneesmiddelen die in aanmerking komen voor het aanvragen van terugbetaling in de verschillende Europese lidstaten. EFPIA keek vervolgens na hoeveel van deze geneesmiddelen op 1 januari 2022 werden terugbetaald en dus beschikbaar waren voor patiënten.
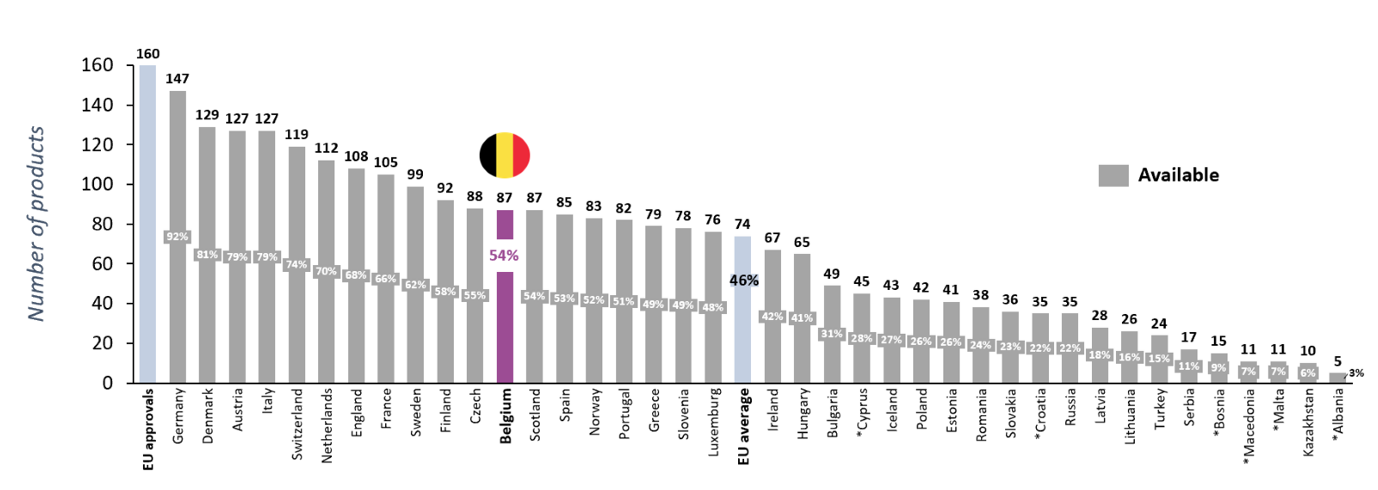
Van de 160 bestudeerde geneesmiddelen waren er begin 2022 slechts 87 terugbetaald in België. Dit betekent dat de helft (54%) van de geneesmiddelen die een marktvergunning kregen, beschikbaar waren voor Belgische patiënten. Hiermee staan we op de 12de plaats. Vergelijken we België met de West-Europese landen, dan zien we dat Belgische patiënten beduidend minder toegang hebben tot innovatieve geneesmiddelen dan patiënten in vergelijkbare Europese landen.
Eerlijkheidshalve moeten we meegeven dat het percentage van terugbetaling niet alleen bepaald wordt door de uitkomst van de terugbetalingsprocedure, maar ook door het al dan niet indienen van een terugbetalingsaanvraag door de bedrijven. Bedrijven worden dan ook bekritiseerd omdat ze voor sommige geneesmiddelen geen terugbetaling aanvragen.
Belgische patiënten wachten te lang op nieuwe geneesmiddelen
Een ander belangrijk vergelijkingspunt is het aantal dagen tussen de goedkeuring door het EMA en de terugbetaling van het geneesmiddel.
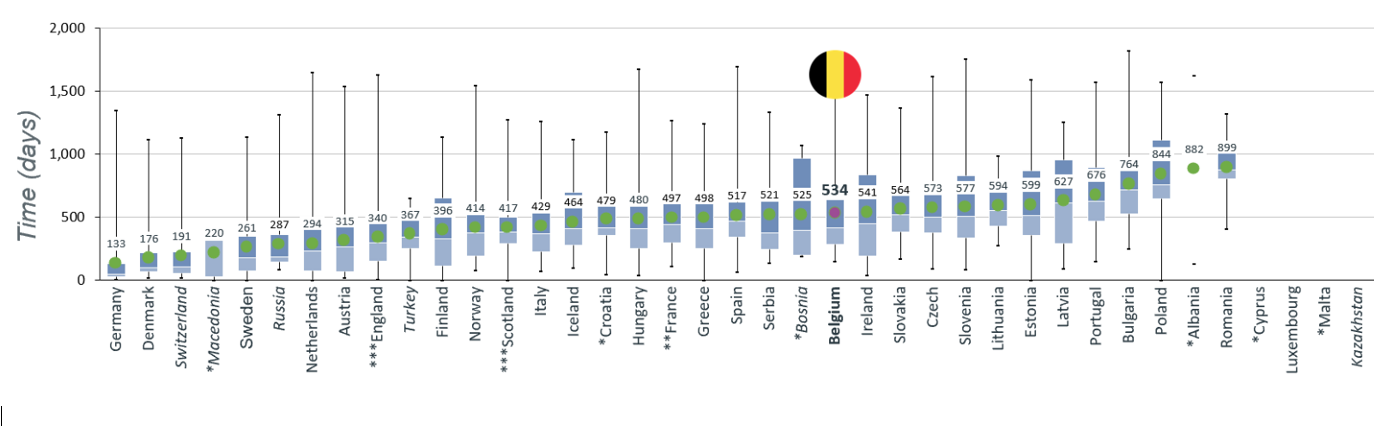
In België liggen er gemiddeld 534 dagen tussen het verkrijgen van de marktvergunning en de terugbetaling. Door deze vertraging landt België op de 23e plaats; in bijna alle West-Europese landen gaat dit proces sneller.
De totale periode bestaat uit twee luiken:
-
Na het verkrijgen van een marktautorisatie volgt een eerste periode van gemiddeld 167 dagen waarin de bedrijven hun terugbetalingsdossier voorbereiden. Pas wanneer alle elementen voor het dossier beschikbaar zijn, kan het bedrijf de aanvraag tot terugbetaling van het geneesmiddel bij het RIZIV indienen.
-
De terugbetalingsprocedure zelf duurt vervolgens gemiddeld 367 dagen.2
Zo zitten er in totaal 534 dagen tussen de marktautorisatie en het moment waarop het geneesmiddel effectief is terugbetaald en door artsen kan voorgeschreven worden.
Dat er veel voorbereiding kruipt in het aanvragen van een terugbetaling komt doordat het terugbetalingsdossier in België zeer uitgebreid is en een antwoord moet bieden op meerdere, bij wet vastgestelde criteria. Voor innovatieve geneesmiddelen moet het bedrijf niet alleen wetenschappelijk bewijs van de therapeutische waarde van het geneesmiddel leveren. Er moet ook een farmaco-economisch model gebouwd worden met Belgische gegevens, en een raming gemaakt van de budgetimpact van het geneesmiddel voor de Belgische ziekteverzekering.
Zo’n voorbereiding vergt van bedrijven tijd, middelen, gegevens en expertise. Kleine bedrijven geven soms aan dat ze niet over de middelen beschikken om in verschillende Europese landen tegelijkertijd een aanvraag tot terugbetaling in te dienen. En dat ze daarom de voorkeur geven aan landen waar de terugbetalingsprocedure minder omslachtig is en sneller verloopt, zoals Duitsland, Denemarken, Zwitserland, Oostenrijk en Nederland.
Met een ambitieuze overheid kan België Europese koploper worden op het vlak van terugbetaling
pharma.be roept de beleidsmakers op om deze middelmatige cijfers aan te grijpen om werk te maken van een modernisering en een versnelling van de procedures voor terugbetaling van geneesmiddelen in ons land. Laten we ambitie tonen en streven naar een koploperspositie in Europa wat betreft toegang tot innovatieve geneesmiddelen. Zo krijgen Belgische patiënten ruim en snel toegang tot innovatieve geneesmiddelen.


Schrijf je in op onze nieuwsbrief
Wil je op de hoogte blijven van het reilen en zeilen binnen de farma-industrie, schrijf je dan in op onze nieuwsbrief!


