
Quatre domaines d’action pour enfin répondre aux patients atteints de maladies rares
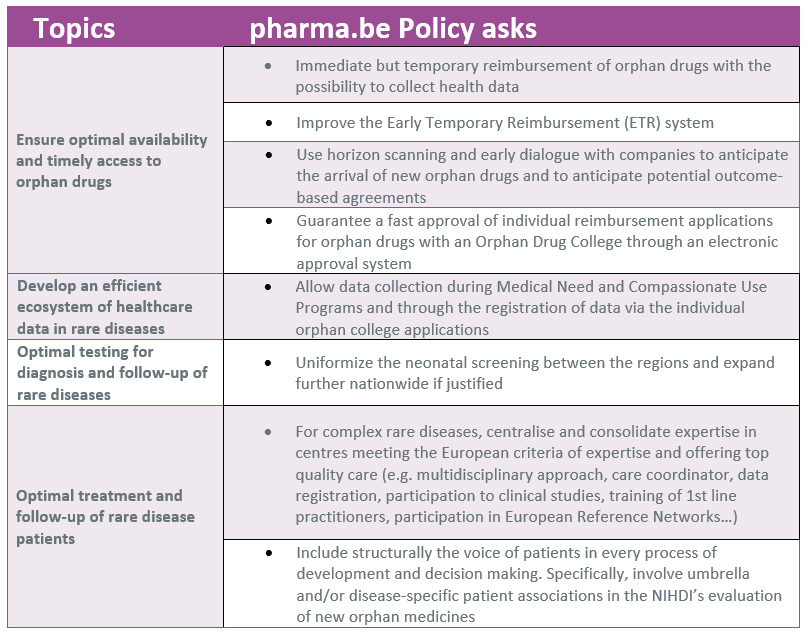
Depuis 2014, grâce aux incitations européennes et nationales, le nombre de médicaments désignés comme orphelins et autorisé par l’EMA a fortement augmenté, atteignant presque 210 approbations en Europe. À ce jour, les maladies rares identifiées sont elles aussi de plus en plus nombreuses (au moins 8.000), 85% d’entre elles ne touchant que quelques patients ou familles en Europe, ce pourquoi pharma.be appelle à la consolidation et à la centralisation de l’expertise dans ce domaine.
Parce que souvent, elles débutent dans la petite enfance puis s’aggravent, il est important de diagnostiquer ces maladies rares tôt dans toutes les régions de notre pays. A cette fin, notre association insiste pour que le screening néonatal soit uniformisé et élargi.
De même, une fois la pathologie diagnostiquée, il est crucial que les patients aient accès le plus rapidement possible aux traitements. Dans cette optique, au niveau de l’EMA, l’objectif est d’enregistrer les médicaments de plus en plus tôt, parfois de manière conditionnelle, malgré les incertitudes à ce stade de développement. Si l’on veut que l’accès réel aux médicaments suive la même tendance, et soit lui aussi plus rapide tout en gérant les incertitudes, il faut, encore plus, qu’aujourd’hui :
- anticiper l’arrivée des nouvelles thérapies (horizon scanning, dialogue précoce)
- soutenir un lancement précoce des médicaments orphelins (procédure d’ETR plus efficace, et un remboursement immédiat mais temporaire)
- développer, quand c’est applicable, des modèles de paiement à la performance (outcome-based agreements) rassurant les autorités que les dépenses sont bien liées aux résultats
- faciliter l’enregistrement de données de vie réelle (collecte de données pendant le MNP/CUP, collecte de données pendant le remboursement temporaire, collecte de données via les demandes aux collèges orphelins).
De même, pour les médicaments orphelins soumis à l’approbation d’un Collège, il ne faut pas perdre de temps dans l’approbation des demandes individuelles de remboursement par un système papier trop lent. pharma.be insiste pour que les demandes puissent se faire via un outil électronique efficace.
Enfin, il est particulièrement important dans les maladies rares de connaître les points d’attention et priorités des patients, aussi bien dans la procédure d’enregistrement européenne que de remboursement national, en incluant les associations de patients dans les procédures de remboursement.

Si la Belgique a été parmi les premiers pays européens à développer un plan national sur les maladies rares et a mis en place des incitants locaux efficaces, des mesures pourraient encore être prises pour accélérer le dépistage des patients, accélérer l'accès aux nouveaux médicaments orphelins et optimiser le traitement des patient.

Intéressé(e) à recevoir les nouvelles de pharma.be
Etre au courant de ce qui vit au sein de l'industrie pharmaceutique ? Inscrivez-vous à notre lettre d'information.


